Artemisia: un tout pour le paludisme
Projet de production locale et de traitement dans les pays les plus pauvres
[1] Professeur honoraire de chirurgie orthopédique infantile, Université de Franche Comté. F-25000 Besançon. www.acmc-ong.net
[2] Ingénieur agricole ISARA Lyon. Artemisia Contre Paludisme 7 Grande Rue F-25330 Longeville.
[3] Artemisia Contre Paludisme 7 Grande Rue F-25330 Longeville. www.acp-paludisme.info
Artémisia Contre Paludisme
Amis Comtois des Missions Centrafricaines
L’ARTEMISIA ANNUA
Ce qu’il faut savoir en pratique (petit résumé des pages suivantes)…
1) La Culture de l’Artemisia Annua
Semis : les graines d’Artemisia annua sont très petites (plus de 10 000 graines par gramme) et il est conseillé de les mélanger avec du sable. Il faut semer dans une boite remplie de terre meuble et bien arrosée. Idéalement il faut préparer la terre avec du compost et de la terre de termitière, puis légèrement tasser la terre avec un rouleau ou une planche, puis semer. Il faut garder la graine en atmosphère humide et arroser généreusement surtout si l’on plante en saison sèche. Pour conserver l’humidité, qui est essentielle pour la germination, on peut recouvrir la zone semée avec une fine couche de terre meuble ou de sable ou un film de plastique. Fin ou de la cendre (une cuillerée de graines pour 5 à 6 cuillerées de sable ou de cendre) avant de semer.
Un repiquage est nécessaire ; on le réalise lorsque le semis devient trop dense, habituellement 3 à 4 semaines après le semis, ou lorsque les plants atteignent 4 cm de haut, en repiquant chaque plant dans de petits pots (type pots de yaourt).
Puis quand les plants ont atteint une hauteur de 15 cm, ou que 5 à 6 feuilles ont poussé, on peut repiquer en pleine terre, habituellement après 3 nouvelles semaines. Après avoir préparé la terre, on repique tout le contenu du pot, en espaçant suffisamment les plants. Il faut arroser et désherber au début ; par la suite aucun traitement particulier n’est nécessaire. Lors du repiquage, l’espace entre les plants peut n’être que de 30 à 60 cm étant donné la petite taille des plants à maturation.
La croissance ultérieure demande plusieurs semaines. Sous des climats tempérés, comme c’est le cas en France, la plante peut atteindre une hauteur de 1,5 à 2 mètres et il faut repiquer en ménageant des intervalles de 80 cm entre les plants, pour avoir un espacement suffisant. Lorsque la durée du jour est invariable, comme c’est le cas en Afrique noire, la maturation est rapide et la croissance des plants ne dépasse pas 20 à 80 cm de hauteur.
Les semences sont photosensibles et la germination est meilleure si les graines restent proches de la surface. Par ailleurs si la plante adulte est répulsive pour les insectes, les jeunes pousses peuvent être ravagées par les chenilles et on peut les protéger par un traitement avec des solutions à 1% d’huile ou d’extrait de neem, ou même de traiter le sol avec une telle solution avant semailles.
2) La récolte des feuilles
Classiquement il faut la faire dès le bourgeonnement des fleurs, au début de la floraison, car la concentration en artémisine est maximum au moment du bourgeonnement et décroit rapidement après la floraison. En fait des travaux récents ont montré que la teneur en artémisine n’est pas un élément essentiel, et on peut faire la récolte jusqu’en fin de floraison.
La récolte se fait habituellement 4 à 5 mois après la plantation.
Le procédé de récolte le plus simple consiste à couper les plants à leur base, puis les étaler sur un tissu pour le séchage. On peut aussi les suspendre par la base dans un endroit ventilé. Le séchage est indispensable pour éviter que les euilles ne moisissent, et d’autre part car la concentration en artémisine est nettement plus importante dans les feuilles sèches que dans les feuilles vertes ; il peut se faire à l’ombre ou au soleil, le séchage à l’ombre étant préférable pour la teneur en artémisine.
Lorsque la plante est sèche (après quelques semaines) il faut détacher les feuilles des tiges les plus volumineuses. Les feuilles contiennent surtout l’artémisine, mais elles ne sont pas seules à contenir les principes actifs ; les tiges contiennent notamment les flavonoïdes et il est préférable de garder les petites tiges sur lesquelles s’attachent les feuilles.
Ceci peut se faire en empaumant les plants à leur base et en arrachant les feuilles en remontant la main de bas en haut le long de la tige. On peut aussi ne pas couper la tige, la laisser sur pied et arracher chaque tigelle une par une, puis faire sécher.
Ce procédé est nettement plus long, mais les feuilles gardent leur aspect normal et surtout la teneur en artémisine est maximum. Enfin après séchage il faut stocker les feuilles dans des sacs en tissu opaque dans un endroit frais et à l’ombre et éviter soigneusement de ré humidifier les feuilles.
Il peut être difficile de déterminer précisément la phase de transition entre les feuilles et la floraison, car les feuilles ont tendance à disparaître au moment du bourgeonnement ; de plus les fleurs sont de très petite taille, avec une coloration jaunâtre, et il est souvent délicat de les différencier de petites feuilles.
3) La récolte des graines
Elle ne doit être faite ni trop tôt car elles risquent de ne pas être arrivées à maturité, ni trop tard car elles risquent de tomber par terre et d’être perdues. Le procédé le plus simple consiste à couper les tiges et à les faire sécher.
On peut ensuite les secouer contre un plan dur ou les battre pour faire tomber les graines. Quand les graines sont en formation, on peut enfermer les terminaisons florales (sans les serrer) dans un petit sac en plastique percé de trous, afin d’éviter la dissémination des graines et de limiter les impuretés.
A noter que si l’on récolte les feuilles juste avant la floraison, on risque de compromettre la récolte de graines. Lorsque l’on commence une plantation d’Artemisia annua, il faut donc ne pas récolter toutes les feuilles et conserver une partie des plants pour récolter ultérieurement les graines, en les repérant avec un tissu ou une marque quelconque.
4) La préparation de la tisane
La quantité de feuilles recommandée pour la préparation en tisane est de 5 à 7 grammes de feuilles pour un litre d’eau bouillante (soit une bonne cuiller à soupe).
Il faut utiliser un récipient en plastique ou mieux en verre pour faire infuser, et éviter un récipient en fer (le fer réagissant avec l’artémisine).
Il faut verser l’eau bouillante sur les feuilles (ne pas poursuivre l’ébullition avec les feuilles, car cela détruit l’artémisine), remuer le mélange avec une cuiller en bois, puis laisser infuser 10 minutes, le récipient étant recouvert. Puis il faut filtrer la tisane (par exemple dans un tissu pour éviter le contact avec une passoire en fer), presser les feuilles pour récupérer les reliquats d’artémisine dissoute, et enfin laisser refroidir la tisane.
A noter que l’on peut également utiliser de l’Artemisia annua fraîche, avec des résultats aussi bons. Il faut alors faire macérer une poignée de feuilles dans de l’eau, puis essorer et boire le jus, ou encore piler une poignée de plante, presser la pâte obtenue, et boire.
5) La posologie de la tisane
Chez l’adulte, la posologie recommandée est de 1 litre par jour en 4 prises de 250 cc. Chez l’enfant, la posologie est de 15 à 20 cc/kg, c’est-à-dire ½ litre en 4 prises pour un poids de 30 kg (4 fois un pot de yaourt bien rempli), ou 120 à 130 ml en 4 prises pour un poids de 7 kg (4 fois un quart de pot de yaourt).
Lorsque l’administration par voie orale est impossible, (en cas de neuropaludisme avec coma…), l’administration par voie rectale est possible sous forme de goutte-à-goutte à l’aide d’une canule rectale, avec la même posologie que par voie orale, c’est-à-dire pour l’adulte un litre de tisane dans laquelle ont infusé 9 à 10 grammes de feuilles d’Artemisia annua, à répéter les jours suivants.
6) La préparation en poudre
La plante peut être directement consommée si elle est parfaitement réduite en poudre. La poudre peut alors être mélangée aux aliments (yaourt, beurre d’arachide, confiture...) ; l’alternative est une préparation en gélules. Il n’existe pas d’études précises concernant la posologie à recommander pour l’utilisation de la poudre, mais on a constaté empiriquement qu’une dose quotidienne de 1 à 2 grammes (4 petites cuillérées à café réparties dans la journée pour traiter un accès de paludisme, une petite cuiller à café par jour pour la prévention) est suffisante pour faire chuter la parasitémie et ce dosage semble actuellement pouvoir être retenu.
7) Ce que l’on peut retenir en 2014…
On peut retenir les quelques points suivants :
L’artémisine est présente surtout dans les feuilles, mais les flavonoïdes sont présents surtout dans les tiges de l’Artémisia annua ; il est donc préférable de prélever non seulement les feuilles mais aussi les tigelles de la plante pour faire la poudre ou la tisane.
L’Artémisia annua fraîche est aussi efficace que les feuilles séchées ; on peut donc l’utiliser sous les deux formes, éventuellement même en pilant la plante fraîche, ce qui peut simplifier la préparation.
La teneur en artémisine n’étant pas l’élément principal, il n’est pas nécessaire de récolter les feuilles exactement au début de la floraison, mais pendant ou même juste après celle-ci.
L’adjonction de sucre, parfois proposée pour neutraliser l’amertume de la tisane, facilite l’administration chez l’enfant.
L’Artémisia annua en poudre est nettement plus efficace que la tisane et elle semble à privilégier lorsque cela est possible.
L’Artémisia annua a un rôle curatif, mais aussi un rôle préventif (une prise hebdomadaire serait suffisante…).
AVANT PROPOS
L’utilisation de l’Artémisia annua dans le traitement du paludisme est un sujet « brûlant », qui déchaine les passions et qui est source d’interminables controverses, parfois sans grande objectivité.
D’innombrables travaux ont été consacrés au traitement du paludisme par l’Artémisine extraite de l’Artemisia annua ; mais il ressort de plus en plus des travaux actuels que ce n’est pas seulement l’artémisine, mais la plante entière qui est efficace sur le paludisme, utilisée soit en tisane, soit en poudre.
Et certaines publications vont jusqu’à mettre en doute le rôle de l’artémisine…
Le but de ce travail est de présenter de la façon la plus complète possible cette méthode de traitement, depuis la culture de la plante jusqu’à l’analyse de l’efficacité de la plante.
L’Artémisia annua apporte non seulement l’artémisine (nous préférons dire artémisine, terme plus français que « artémisinine », dérivant du mot anglais artemisinin), mais aussi les nombreuses autres molécules présentes dans la plante, qui ont une action synergique de l’artémisine.
Tel qu’il est, ce texte comporte très probablement des lacunes ou des inexactitudes ; nous serons heureux de les corriger… Nous souhaitons que ce livret permette à ceux qui le souhaitent de tenter l’expérience de la culture et de l’usage de l’Artémisia annua.
INTRODUCTION
Le paludisme reste un problème de santé mondial, responsable de la mort de plusieurs millions de personnes chaque année, dont une très forte proportion d’enfants. Il est actuellement officiellement admis que le traitement à base d’artémisine combinée à des molécules à action plus lente (ACT : artemisinin combined therapy) est le moyen le plus efficace pour lutter contre le paludisme dû au Plasmodium falciparum (1,2). C’est le traitement recommandé par l’OMS (3). L’artémisine supprime la parasitémie plus rapidement que tout autre antipaludéen ; elle agit précocement dans le cycle parasitaire par son effet parasitocide (4), les molécules à action plus lente prenant ensuite le relais. Cependant ces médicaments à action plus lente sont connus pour être pour la plupart devenus inefficaces en face du Plasmodium Falciparum. Par ailleurs les traitements actuels à base d’artémisine ou de ses dérivés semi-synthétiques (arthemeter, artésunate, arteether) restent coûteux (près de 10 fois plus chers que les traitements classiques par sels de quinine) et donc le plus souvent non accessibles à la plupart des familles dans les pays les plus pauvres. Enfin ces traitements ne sont pas toujours disponibles dans les régions endémiques les plus reculées.
Dans une méta-analyse portant sur 55 publications, White (5) constate que le coût du traitement de l’accès palustre non compliqué est en moyenne de 5,84 $. Dans une étude faite à Bangui (République Centrafricaine) portant sur la disponibilité des antipaludéens et leur utilisation, Manirakiza (6) constate que les traitements par artémisine ou dérivés n’étaient disponibles que dans 35 sur 82 établissements évalués, et le médicament le plus couramment prescrit et utilisé restait la Chloroquine (66,7%), l’arthemeter ne représentant que 2,4% des antipaludéens utilisés. En 2008, selon le Rapport mondial sur le paludisme de l’OMS (7), 38% des enfants fébriles étaient mis sous traitement antipaludique en Afrique noire, et seulement 3% avaient accès aux ACT.
De plus la durée de vie de l’artémisine et surtout de ses dérivés est brève (8), ne dépassant pas quelques semaines, notamment en cas de conservation à température ambiante de plus de 35°. Enfin, les présentations disponibles sur les marchés sont parfois des imitations d’origine douteuse, à teneur en artémisine insuffisante ou contenant d'autres substances totalement inactives ou même toxiques, posant un véritable problème de santé publique.
Newton (9) a rassemblé 391 échantillons de médicaments douteux vendus sous le nom d’artésunate dans le Sud-Est asiatique. La moitié d’entre eux (49,9 %) ne contenait pas d’artésunate ou en trop faible quantité. Par contre d’autres molécules étaient présentes, dont certaines à potentiel cancérigène. Dans une étude semblable portant sur des médicaments vendus sous le nom d’artésunate, Sengaloundeth (10) a constaté que dans 22 cas sur 25 les comprimés étaient des médicaments contrefaits sans aucune trace d’artésunate.
Pourtant, en raison de sa grande efficacité immédiate, l’artémisine pourrait être une solution pour résoudre la tragédie que représente le paludisme chez l’enfant dans les régions endémiques. La préparation des feuilles d’Artemisia annua (ou Quinghao) sous forme de tisane est utilisée dans la médecine traditionnelle chinoise depuis des siècles ; elle a été redécouverte par les Chinois lors de la guerre du Vietnam. L’artémisine en a été extraite en 1975 ; elle a été considérée comme le principal agent antipaludéen et elle a été proposée pour le traitement de toutes les formes de paludisme chez l’homme, et notamment le paludisme du au plasmodium falciparum multi-résistant.
Cependant, au vu de la littérature récente, il apparait que le potentiel antipaludéen de l’Artemisia annua n’est pas uniquement dû à l’artémisine, et plusieurs travaux ont montré que de nombreuses autres molécules contenues dans la plante, essentiellement des flavonoïdes, ont également une action antipaludéenne propre ou synergique de l’artémisine. Le rôle des flavonoïdes présents dans les feuilles et les tiges d’Artemisia annua valorise beaucoup l’utilisation non de la molécule d’artémisine, mais de la plante entière pour traiter l’accès palustre (11, 12, 13, 14). Il a même été montré que l’Artemisia afra, variété d’Artemisia qui ne contient pas d’artémisine, est aussi efficace que l’Artemisia annua sur le Plasmodium Falciparum (15, 16). Il semble donc que l’importance donnée à l’artémisine ait été surestimée…
L’Artémisia annua peut être réduite en poudre et administrée sous forme de gélules ou même simplement mélangée aux aliments. Les gélules sont plus simples à administrer que la tisane, elles apportent toutes les molécules présentes dans les feuilles, et sont même utilisables par voie rectale chez l’enfant, mais elles sont plus coûteuses et non facilement réalisables sur place.
L’Artémisia annua peut être cultivée sous tous les climats, et de ce fait elle peut être disponible sur place. La tisane peut être consommée pour un coût pratiquement nul. Cependant l’artémisine a pour inconvénient sa rapidité d’élimination, et donc la brièveté de son action. Cela expose à un risque de récidive précoce de l’accès palustre, et cela impose de poursuivre le traitement par tisane durant plusieurs jours.
Malgré ces imperfections, il est tentant de proposer de traiter l’accès palustre par l’administration de tisane à base de feuilles d’Artémisia annua, quasi gratuite et quasi universellement cultivable sur place, comme une alternative aux traitements médicamenteux modernes, coûteux et parfois non disponibles.
On retrouve d’ailleurs dans la littérature des plaidoyers comme celui de Graz (17) en faveur d’un retour à une médecine de type traditionnel de ce type. A partir d’une revue de la littérature portant sur la culture de l’Artémisia annua et portant sur l’efficacité de l’artémisine et des flavonoïdes présents dans la tisane, et à partir de l’analyse de quelques cas personnels traités par gélules ou tisane d’Artémisia annua, les auteurs évaluent ce moyen de traitement de l’accès palustre, non plus comme une alternative dans les cas où les traitements officiels ne sont pas disponibles localement, mais comme un traitement à part entière et tout aussi efficace.
Ils ont développé un programme de culture de l’Artémisia annua dont les buts sont de fournir localement des semences aux populations vivant dans les régions sous-développées à endémie paludéenne, de favoriser la culture et la production locale de l’Artémisia annua, de promouvoir la connaissance de la plante et de fournir documents et conseils. Pour ce faire, ils ont créé une association non gouvernementale « Artemisia Contre Paludisme (ACP) » dont le siège est situé à Longeville (Franche Comté, France). La plante est cultivée en pleine terre à une altitude de 700 m, sans fertilisants.
Références
1. White NJ, Nosten F, Looareesuwan S, Watkins WM, Marsh K, Snow RW, Kokwaro G, Ouma J, Hien TT, Molyneux ME, Taylor TE, Newbold CI, Ruebush II TK, Danis M, Greenwood BM, Anderson RM, Olliaro P. Averting a malaria disaster. Lancet 1999, 353: 1965-7.
2. WHO meeting on the production of artemisinin and artemisinin-based combination therapies, 6–7 June 2005, Arusha, United Republic of Tanzania
3. Olumnese P. WHO guidelines for the treatment of malaria, World Health Organization, Geneva 2006.
4. Alin MH, Björkman A. Concentration and time dependency of artemisinin efficacy against Plasmodium falciparum in vitro. Am J Trop Med Hyg 1994 ; 50 : 771-76.
5. White MT, Conteh L, Cibulskis R, Ghani AC. Costs and cost-effectiveness of malaria control interventions - a systematic review. Malaria Journal (2011), 10 :337. http://wwwmalariajournal.com/content/10/1/337).
6. Manirakiza A, Njuimo SP, Le Faou A, Malvy D, Millet P. Availability of Antimalarial Drugs and Evaluation of the Attitude and Practices for the Treatment of Uncomplicated Malaria in Bangui, Central African Republic. Journal of Tropical Medicine, Volume 2010, Article ID 510834, 5 pages, doi:10.1155/2010/510834.
7. World malaria report 2008. World Health Organization, Geneva 2008
8. Houzé S, Munier A, Paoletti X, Kaddouri H, Ringwald P, Le Bras. Shelf Life of Predosed Plates Containing Mefloquine, Artemisinin, Dihydroartemisinin, and Artesunate as Used for In Vitro Plasmodium falciparum Susceptibility Assessment. J Clin Microbiol 2007, 45: 2734-36.
9. Newton PN, McGready R, Fernandez F, Green MD, Sunjio M, Bruneton C, Phanouvong S, Millet P, Whitty CJM, Talisuna AO, Proux S, Christophel EM, Malenga G, Singhasivanon P, Bojang K, Kaur H, Palmer K, Day NPJ, Greenwood BM, Nosten F, White NJ. Manslaughter by Fake Artesunate in Asia—Will Africa Be Next? PLoS Med. 2006 June; 3(6): e197.
10. Sengaloundeth S, Michael D Green MD, Fernández FM, Manolin O, Phommavong K, Insixiengmay V, Hampton CY, Nyadong L, Mildenhall DC, Hostetler D, Khounsaknalath L, Vongsack L, Phompida S, Vanisaveth V, Syhakhang L, Newton PN. A stratified random survey of the proportion of poor quality oral artesunate sold at medicine outlets in the Lao PDR – implications for therapeutic failure and drug resistance. Malaria Journal 2009, 8:172.
11. De Donno A, et al. First-time comparison of the in vitro antimalarial activity of Artemisia annua herbal tea and artemisinin. Trans R Soc Trop Med Hyg (2012), http://dx.doi.org/10.1016/j.trstmh.2012.07.008
12. Ferreira JFS, Luthria DL, Sasaki T, Heyerick A. Flavonoids from Artemisia annua as antioxidants and their potential synergism with artemisinin against malaria and cancer. Molecules 2010, 15, 3135-3170.
13. Goulart H R, Kimura E A, Peres V J, Couto A S, Aquino Duarte F A, Katzin A M. Terpenes Arrest Parasite Development and Inhibit Biosynthesis of Isoprenoids in Plasmodium falciparum Antimicrobial Agents and Chemotherapy, July 2004, 48 : 2502-9.
14. Gueye El Hadj O. Etude clinique sur l’efficacité thérapeutique de l’Artemisia annua sur l’accès palustre simple (à paraitre).
15. Abrahams MA. Bioassay-guided fractionation of Artemisia afra for in vitro antimalarial activity against Plasmodium falciparum. (1996) Thesis, Cape Town University.
16. Lubbe A, Seibert I, Klimkait T, van der Kooy F. Ethnopharmacology in overdrive : the remarkable anti-HIV activity of Artemisia annua. J Ethnoparmacol, (2012), doi:10.1016/j.jep.2012.03.024
17. Graz B, Kitua A Y and Malebo H M. To what extent can traditional medicine contribute a complementary or alternative solution to malaria control programmes? Malaria Journal 2011, 10(Suppl 1):S6 doi:10.1186/1475-2875-10-S1-S6.
L’HISTOIRE DE L’ARTEMISIA ANNUA
C’est à la suite des ravages faits par le paludisme dans les rangs de l’armée nord-vietnamienne que Mao Tsé Toung a mis en route en 1967, en pleine révolution culturelle, le projet « 523 » (ainsi nommé parce qu’il a été lancé le 23 Mai 1967), qui était un programme secret de recherche sur le traitement du paludisme, basé sur l’étude des traitements de la médecine traditionnelle chinoise (1).
L’Académie de Médecine Traditionnelle Chinoise a confié cette recherche à un groupe de chercheurs, dont Youyou TU, jeune pharmacienne âgée de 36 ans, dont le nom est resté totalement ignoré jusque dans les années récentes (2).
Il faut dire que, durant la révolution culturelle, l’individu passait au deuxième plan derrière le groupe, et qu’il pouvait être dangereux de se faire trop remarquer. Il est intéressant de noter que les premières publications consacrées à l’artémisine (3) ne comportaient pas de nom d’auteur…
Ce n’est qu’en 2005 que le nom de Youyou TU a été associé à la découverte de l’artémisine, et qu’elle est devenue célèbre : "Je participais à une réunion à Shangai en 2005 avec tous les spécialistes chinois du paludisme, et j’ai demandé qui avait découvert l’artémisine," raconte Louis Miller, un chercheur sur le paludisme au US National Institutes of Health de Rockville, Maryland. "J’ai été surpris de découvrir que personne ne le savait."
En 2011, Youyou TU a reçu le prestigieux prix Lasker DeBakey Clinical Research (4).
Youyou TU a rassemblé plusieurs milliers de recettes à base d’herbe ; elle a évalué 380 extraits de différentes plantes, parmi lesquelles l’Artémisia annua (ou Qinghao), qui était connue depuis très longtemps pour son efficacité pour traiter la fièvre récurrente.
Ainsi, au 4ème siècle, GE HONG en donnait une recette de préparation très précise : « prendre une branche d’Artémisia annua ; faire tremper dans 400 ml d’eau ; presser vigoureusement, recueillir le jus et boire ».
Ou encore « piler soigneusement une branche d’Artémisia annua dans un mortier, puis presser pour recueillir le jus, et boire ». A noter qu’il s’agit dans ces préparations de plante fraîche, et non pas de feuilles séchées… A noter également qu’il s’agit de toute la plante et non pas seulement des feuilles… (5).
Plus tard, au 11ème siècle, SHEN GUA recommandait l’utilisation d’Artémisia apiacea (couleur bleu vert en période de floraison) plutôt que Artémisia annua (coloration vert clair), en raison d’une efficacité plus importante (6).
Or l’Artémisia apiacea contient beaucoup de flavonoïdes, mais peu d’artémisine (7)…
Les premiers résultats obtenus par Youyou TU ont été décevants, car les extraits étaient préparés avec de l’eau bouillante qui détruisait les composants actifs.
C’est en 1971, en réalisant une extraction par de l’éther à basse température, qu’elle a obtenu des extraits qu’elle a testés en laboratoire sur des souris et des singes infectés par le parasite, avec une efficacité pratiquement de 100% (8).
Après avoir vérifié sur elle-même l’innocuité de l’extrait, elle l’a testé sur l’homme, sur 21 patients impaludés, qui ont été guéris à 90%. En 1972 elle a isolé une substance considérée comme l’élément actif de l’Artémisia annua, et lui a donné le nom d’artémisine (ou Qinghaosu, le suffixe su signifiant « la substance active »).
Mais on peut encore noter que les premiers essais positifs avaient été faits avec de l’Artémisia annua produite dans la région de Pékin, contenant peu d’artémisine.
Comme Youyou TU désirait disposer de beaucoup d’artémisine, elle a ensuite utilisé de l’Artémisia annua provenant de la région du Sichuan, très riche en artémisine, avec des résultats cliniques identiques, ce qui suggère encore que la concentration optimale en artémisine n’est pas nécessairement la concentration maximale…
En 1975 Youyou TU a déterminé la structure de la molécule d’artémisine (sesquiterpène lactone). En 1979 la publication d’un article dans le Chinese Medical Journal (3) fait connaitre l’artémisine ; en 1981, le 4ème congrès du Groupe de Travail Scientifique sur la Chimiothérapie du Paludisme, sponsorisé par le PNUD, la Banque Mondiale et l’OMS, se tient à Pékin.
L’artémisine devient connue dans le monde entier, et elle soulève l’intérêt des grandes firmes pharmaceutiques, qui produisent les dérivés semi-synthétiques que l’on connait (artésunate hydrosoluble, arthémeter liposoluble…), aboutissant en 1986 à la mise sur le marché des premiers médicaments à base d’artémisine.
Devant l’efficacité du produit, en 2004 l’OMS en commence la promotion à grande échelle, et recommande son utilisation en association avec d’autres molécules « classiques » (les ACT, ou Artemisinin Combined Therapy).
Enfin, en 2011, l’OMS recommande l’utilisation de l’artésunate en monothérapie par voie intra veineuse au lieu de sels de quinine dans le traitement du paludisme grave de l’enfant.
Références
1. Li Y, Wu YL. How Chinese scientists discovered qinghaosu (artemisinin) and developed its derivatives? What are the future perspectives? Med Trop (Mars). 1998;58 (3 Suppl) : 9-12.
2. McKenna P. The modest woman who beat malaria for China. New Scientist, 15 November 2011.
3. X. Antimalaria studies on Qinghaosu. Chin Med J (Engl), 1979, 92:811-6.
4. Neill US. From branch to bedside: Youyou Tu is awarded the 2011 Lasker~DeBakey Clinical Medical Research Award for discovering artemisinin as a treatment for malaria. , 2011, 3; 121 : 3768-73.
5. Wright, C.W.; Linley, P.A.; Brun, R.; Wittlin, S.; Hsu, E. Ancient chinese methods are remarkably effective for the preparation of artemisinin-rich extracts of qing hao with potent antimalarial activity. Molecules 2010, 15, 804–812.
6. Hsu E. Reflections on the 'discovery' of the antimalarial qinghao. Br J Clin Pharmacol. 2006, 61:666-70.
7. Lee IS, Kim KS, Jang JM, Park Y, Kim YB, Kim BK. Phytochemical constituents from the herba of artemisia apiacea. Arch Pharm Res, 2002, 25 : 285-88.
8. Youyou Tu. The discovery of artemisinin (quinghaosu) and gifts from Chinese medicine. Nature Medicine, 2011, 17:1217-1220.
LA CULTURE DE L’ARTEMISIA ANNUA
Semis: les graines d’Artemisia annua sont très petites (plus de 10 000 graines par gramme) et il est conseillé de les mélanger avec du sable fin ou de la cendre (une cuillerée de graines pour 5 à 6 cuillerées de sable ou de cendre) avant de semer. Bien mélanger pour avoir des plantules bien réparties.
Préparation du terreau pour le semis :
Il faut tamiser la terre avec une passoire ou mieux un morceau de grillage comme celui que l'on met aux fenêtres pour se protéger des moustiques. On peut utiliser une bassine, une brouette ou a même le sol pour récupérer la terre tamisée. La quantité de terre tamisée doit convenir au semis. Il faut un terreau bien fin. La terre de termitière est excellente.
Stérilisation de la terre :
La stérilisation de la terre est un passage souhaitable. Les jeunes plants sont fragiles et susceptibles de diverses attaques : pour cela on peut placer une bâche noire sur le terreau humide pendant 5 jours. L'ensemble est exposé en plein soleil.
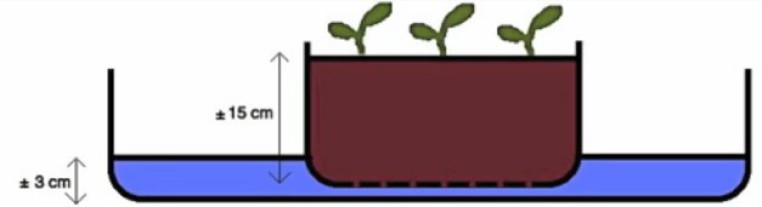
Fabrication du réceptacle à semis (Fig. 1):
Des bouteilles vides d'eau de 5 litres feront l'affaire. Il faut découper la partie latérale de la bouteille, et percer avec une aiguille le côté opposé sur une vingtaine d'endroits. Remplir la bouteille avec le terreau.
Fig 1. Le réceptacle à semis : il s’agit d’une simple bouteille dont on a découpé une face et troué la face opposée.
On peut maintenant saupoudrer la surface du terreau avec le semis, puis remettre un peu de terreau ; très peu, juste pour stabiliser les graines.
Celles-ci doivent toujours recevoir la lumière car elles sont photosensibles et la germination est meilleure si les graines restent proches de la surface. Enfin on peut arroser les graines avec un vaporisateur, mais sans inonder.
Pour conserver l’humidité, on peut recouvrir le semis avec un plastique transparent.
On peut aussi faire un arrosage par capillarité selon le schéma ci-dessous (Fig. 2), en mettant la bouteille dans un réceptacle plus grand qui contient 3cms d'eau, la hauteur du terreau dans la bouteille étant d’une quinzaine de centimètres environ.
L’humidité sera excellente.
Lors de la croissance du semis, il faut veiller à ce que l'ensemble ne soit pas dans un endroit surchauffé, comme près d'un mur à midi. Un lieu semi ombragé convient.
Après quelques jours, les graines auront germé et on va pouvoir faire le repiquage.
On le réalise lorsque le semis devient trop dense, habituellement 3 à 4 semaines après le semis, ou lorsque les plants atteignent 4 cm de haut, en repiquant chaque plant dans de petits pots (type pots de yaourt).
Remplir les petits pots de terreau tamisé. Arroser raisonnablement afin de ne pas saturer en eau.
Avec une cuillère à café retirer délicatement la plantule du semis, avec une motte de terreau ; poser la motte dans le pot préalablement creusé.
Remettre un peu de terreau autour de la plantule ; tasser légèrement.
Puis quand les plants ont atteint une hauteur de 15 cm, ou que 5 à 6 feuilles ont poussé (fig 4), on peut repiquer en pleine terre.
Le repiquage se fait habituellement après 3 nouvelles semaines.
Après avoir préparé la terre, on repique tout le contenu du pot, en espaçant suffisamment les plants.
 Fig 5. Dans cette plantation, les plants ont poussé dans de petits sacs. Ils sont prêts à être repiqués en pleine terre.
Fig 5. Dans cette plantation, les plants ont poussé dans de petits sacs. Ils sont prêts à être repiqués en pleine terre.
Il faut arroser matin et soir s’il ne pleut pas pendant les premières semaines, et désherber au début ; par la suite aucun traitement particulier n’est nécessaire. La croissance ultérieure demande plusieurs semaines.
Dans l’expérience des auteurs à Longeville, avec un semis au printemps au début du mois d’Avril, le repiquage est réalisé durant la dernière semaine d’Avril et la récolte des feuilles se fait à la fin du mois d’Août.
Sous des climats tempérés, comme c’est le cas en France, la plante peut atteindre une hauteur de 1,5 à 2 mètres et il faut repiquer en ménageant des intervalles de 80 cm entre les plants, pour avoir un espacement suffisant, permettant une bonne croissance et un bon développement des feuilles sur toute la hauteur de la tige.
Cinq grammes de graines sont suffisants pour ensemencer un hectare en pleine terre.
Lorsque la durée du jour est invariable, comme c’est le cas en Afrique noire, la maturation est rapide ; le repiquage s’effectue en moyenne 9 semaines après le semis et la hauteur maximum est atteinte après 12 nouvelles semaines.
La croissance des plants ne dépasse pas 50 à 80 cm de hauteur et lors du repiquage, l’espace entre les plants peut n’être que de 30 à 60 cm étant donné la petite taille des plants à maturation.
En Afrique, il semble que la culture de l’Artemisia annua soit plus difficile, et plusieurs expériences se sont soldées par des échecs. Contrairement à ce que l’on pensait, il semble préférable de ne pas semer directement en pleine terre et donc de semer dans une boîte de terre bien ameublie et surtout d’arroser abondamment.
Différents essais ont été effectués par l’association Artemisia Contre Paludisme : dans une culture faite au Sénégal, le bourgeonnement a commencé 3 mois après le semis et la plante a atteint une hauteur de 60 cm.
Dans une autre culture au Bénin, le semis a été fait en Janvier et le repiquage 3 semaines après ; la hauteur maximum obtenue était de 1 mètre.
Dans un essai de culture au Burkina Faso la plante n’a grandi que jusqu’à 20 à 30 cm.
Dans les pays africains on peut semer à n’importe quelle saison de l’année, mais si l’on sème en saison sèche il faut généreusement arroser jusqu’au repiquage.
LA RECOLTE
La récolte des feuilles se fait habituellement 4 à 5 mois après la plantation. Classiquement elle doit se faire dès le bourgeonnement des fleurs, avant la pleine floraison, car la concentration en artémisine est maximum au moment du bourgeonnement et décroit rapidement après la floraison.
Dans une étude faite à Longeville, où le bourgeonnement s’est produit durant les derniers jours du mois d’Août, la teneur des feuilles en artémisine était de 0,13% le 16 Août, de 0,31% le 26 Août, de 0,31% le 2 Septembre, et de 0,25% le 9 Septembre.
En fait des travaux récents ont montré que la teneur en artémisine n’est pas un élément essentiel, et on peut donc faire la récolte jusqu’en fin de floraison (fig 6).
Il peut être difficile de déterminer précisément la phase de transition entre les feuilles et la floraison, car les feuilles ont tendance à disparaître au moment du bourgeonnement ; de plus les fleurs sont de très petite taille, avec une coloration jaunâtre, et il est souvent délicat de les différencier de petites feuilles.
Le procédé de récolte le plus simple consiste à couper et rassembler les plants, puis à les suspendre dans un local aéré ou les étaler sur un tissu pour le séchage. Le séchage est un temps important, car les feuilles une fois séchées peuvent se conserver plusieurs années.
De plus la concentration en artémisine est plus importante dans les feuilles sèches que dans les feuilles vertes, notamment en cas de récolte précoce (1).
Le mode de séchage est discuté dans la littérature, l’exposition au soleil étant néfaste pour certains (Laughlin, 2) et au contraire favorable pour d’autres (Simonnet, 3).
Dans une étude faite par ACP-Paludisme, la teneur en artémisine est de 0. 30% quand les plants sont séchés au soleil et de 0. 36% quand ils sont séchés à l’ombre, suggérant qu’il est préférable d’éviter l’exposition au soleil. Ferreira (4) a comparé différents modes de séchage : séchage à l’ombre pendant 1 à 3 semaines, séchage au soleil pendant 1 à 3 semaines, séchage au four à 45° avec ventilation pendant 12 à 24 h et séchage par lyophilisation. Il a constaté que le mode de séchage, à l’ombre ou au soleil, ne modifie pas sensiblement la teneur en artémisine.
Par contre le séchage au four, néfaste pour la teneur en artémisine, est plus efficace pour préserver l’activité anti-oxydante des feuilles. Il semble que les conditions optimales pour le séchage soient un séchage à une température faible, ne dépassant pas 20°, plutôt à l’ombre, avec une humidité faible.
Quelque soit le mode de séchage, la teneur en artémisine augmente pendant les trois premiers jours, sa biosynthèse étant déclenchée par le séchage. Lorsque la plante est sèche, il faut détacher les feuilles des tiges. Les feuilles contiennent surtout l’artémisine, mais elles ne sont pas seules à contenir les principes actifs ; les tiges contiennent notamment les flavonoïdes et il est préférable de garder les petites tiges sur lesquelles s’attachent les feuilles.
Ceci peut se faire en frappant les plants contre une surface dure, ou mieux encore en empaumant les plants à leur base et en arrachant les feuilles en remontant la main de bas en haut le long de la tige. Ces techniques ont l’inconvénient de fragmenter les feuilles en fines particules.
On peut piler les feuilles jusqu’à obtention d’une poudre fine que l’on peut conserver dans des récipients ou sacs en plastique opaques. Une telle poudre est nécessaire si l’on veut utiliser la plante en gélules.
Un autre procédé consiste à laisser la tige sur pied et arracher chaque tigelle une par une, puis faire sécher à l’ombre (fig. 7). Le procédé est nettement plus long, mais les feuilles gardent leur aspect normal et surtout elles ont une forte teneur en artémisine (0. 84% dans l’étude faite par ACP-Paludisme).
Enfin après séchage il faut stocker les feuilles dans des sacs en tissu opaque ou en papier solide dans un endroit frais et à l’ombre, et il faut impérativement éviter une ré-humidification de la récolte, qui influe fortement sur la dégradation de l’artémisine.
Contrairement à ce que l’on pensait (5), les feuilles séchées ont une bonne stabilité et leur teneur en artémisine reste satisfaisante à trois ans, à condition qu’elles soient conservées au sec et à l’ombre.
Selon une expérience communiquée par P Lutgen (non publiée), après 7 semaines de conservation à 25°C et 65% d’hygrométrie, de même qu’à 35° C et 75% d’hygrométrie, la concentration reste constante.
Après 39 mois de conservation à 25° C et 65% d’hygrométrie, la concentration reste à 0.78 %, mais elle s’effondre après conservation à 35° C et 75% d’hygrométrie.
Par contre la durée de conservation de la tisane est brève et son efficacité diminue rapidement après l’infusion des feuilles, surtout quand elle est conservée à température ambiante ; il faut donc utiliser de la tisane fraîchement préparée, datant de 24 heures au maximum.
La récolte des graines ne doit être faite ni trop tôt car elles risquent de ne pas être arrivées à maturité, ni trop tard car elles risquent de tomber par terre et d’être perdues.
A Longeville le meilleur moment pour la récolte des graines se situe en automne, juste avant les premières gelées. Le procédé le plus simple consiste à couper les tiges et après séchage à les secouer contre un plan dur ou les battre pour faire tomber les graines.
A noter que si l’on récolte les feuilles juste avant la floraison, on risque de compromettre la récolte de graines.
Lorsque l’on commence une plantation d’Artemisia annua, il faut donc ne pas récolter toutes les feuilles et conserver une partie des plants pour récolter ultérieurement les graines.
On peut repérer quelques pieds et les identifier avec un tissu ou une marque quelconque pour les conserver jusqu'à la floraison.
Quand les graines sont en formation, on peut enfermer les terminaisons florales (sans les serrer) dans un petit sac en plastique percé de trous, afin d’éviter la dissémination des graines et de limiter les impuretés.
Références
1. Lommen WJ, Elzinga S, Verstappen FW, Bouwmeester HJ. Artemisinin and sesquiterpene precursors in dead and green leaves of Artemisia annua L. crops. Planta Med 2007, 73 ; 1133-9.
2. Laughlin J C, Heazlewood GN, Beattie BM. Cultivation of Artemisia annua L. In Artemisia. Wright C W Ed; Taylor & Francis: New York, 2002; Vol.18, pp 159-195.
3. Simonnet X, Gaudin M, Hausammann H, Vergeres C. Le fanage au champ d’Artemisia annua L.: Elever la teneur en artemisinine et abaisser les couts de production. Rev. Suisse Vitic. Arboric. Hortic. 2001, 33, 263–268.
4. Ferreira JFS, Luthria DL. Drying affects Artemisinin, Dihydroartemisinic Acid, Artemisinic Acid, and the Antioxidant Capacity of Artemisia annua L. leaves. J Agric Food Chem, 2010, 58, 1691-98.
5. Green J. The Herbal Medicine-Maker's Handbook. The Crossing Press, Berkeley, California, 2000.
LE CYCLE PARASITAIRE DU PLASMODIUM FALCIPARUM
Résumé : En piquant l’homme, le moustique lui injecte dans le sang sa salive infectée par le parasite. Le parasite gagne d’abord le foie où il se multiplie. Puis, les parasites migrent dans le sang où ils pénètrent dans les globules rouge et les détruisent. Si un moustique sain pique un homme infecté, il s’infecte à son tour et va transmettre la maladie à d’autres humains.
Le parasite (le plus fréquent est le Plasmodium Falciparum, responsable des formes de paludisme les plus graves) se développe en deux cycles : un cycle asexué chez l’homme et un cycle sexué chez le moustique.
1) Chez l’homme : cycle asexué (ou schizogonique).
En piquant l’homme, le moustique lui injecte sa salive qui contient des centaines de parasites (appelés sporozoïtes) provenant de ses glandes salivaires. Les parasites gagnent le foie et pénètrent dans les cellules hépatiques où ils se multiplient, grossissent et finissent par faire éclater la cellule hépatique.
Ils repassent alors dans la circulation sanguine (ils sont alors appelés mérozoïtes) et pénètrent dans les hématies (ou globules rouges) ; ils deviennent alors des trophozoïtes d’abord jeunes, à forme annulaire ; les trophozoïtes grossissent, dégradent l’hémoglobine du globule rouge et se multiplient dans le globule rouge ; on parle alors de schizontes.
Quand il est mûr, le schizonte éclate et libère de nouveaux mérozoïtes qui vont eux-mêmes parasiter des hématies vierges et recommencer le cycle ; chaque cycle dure 48 heures et l’éclatement des globules rouges et des schizontes est contemporain des accès fébriles. Enfin, après plusieurs cycles, on voit apparaître dans les hématies des parasites sexués, les gamétocytes mâles et femelles.
2) Chez le moustique (l’anophèle) : cycle sexué (ou sporogonique).
Lorsqu’il pique un homme infecté, le moustique ingère des schizontes, des mérozoïtes et des gamétocytes. Les schizontes et les mérozoïtes sont digérés dans l’estomac du moustique. Le gamétocyte femelle est fécondé par le gamétocyte mâle, formant un œuf (l’oocyste) qui traverse la paroi de l’estomac du moustique et se fixe sur cette paroi.
Dans l’oocyste se forment des sporozoïtes qui sont libérés par l’éclatement de l’oocyste et gagnent les glandes salivaires. La durée du cycle chez l’anophèle est de 10 à 40 jours.
Lorsque la population est régulièrement exposée à un risque d’inoculation élevé (comme c’est le cas en Afrique subsaharienne), une parasitémie chronique est habituelle, et les accès de paludisme les plus graves sont l’apanage des enfants ; en effet une immunité clinique partielle s’acquiert durant l’enfance, et les adultes ne présentent que peu d’accès palustres, même si le parasite reste présent dans leur sang de façon chronique.
Ce fait particulièrement important est bien précisé dans le rapport de Olumnese sur le traitement du paludisme (64, pp 5-6), et il mérite d’être pris en considération dans l’évaluation de l’efficacité des traitements proposés, bien que la position « officielle » de l’OMS soit de tenir compte à la fois du résultat clinique et du résultat sur la parasitémie dans l’évaluation des résultats.
LE MECANISME D’ACTION DE L’ARTEMISINE
La molécule d’artémisine a été isolée sous forme cristalline en 1972 ; sa structure chimique a été déterminée en 1975 : c’est un sesquiterpène lactone avec un pont endoperoxyde (pont reliant deux atomes d’oxygène).
C’est une molécule à haute énergie, prompte à réagir et à perdre son énergie car peu stable (1).
Des dérivés semi-synthétiques ont été préparés à partir de la molécule d’artémisine : dihydroartemisine, artemether, artesunate and arteether.
La durée de vie de ces dérivés est nettement inférieure à celle de l’artémisine, quelques mois pour l’artésunate (2), et leur efficacité n’est pas sensiblement supérieure à celle de l’artémisine.
L’avantage de l’artesunate est d’être hydrosoluble et d’être facilement utilisable par voie intraveineuse.
L’artémisine a un rôle anti-inflammatoire et antipyrétique ; elle est active non seulement sur le Plasmodium Falciparum, mais également sur de nombreuses bactéries et virus et notamment le VIH (3).
Elle a été utilisée avec succès dans la désinfection de l’eau (4) et sur certaines parasitoses comme les leishmanioses ou les schistosomiases (5).
[1] L’effet anticancéreux de l’artémisine est un sujet particulièrement « brûlant ».
Cet effet a été prouvé à plusieurs reprises in vitro, sur des lignées de cellules cancéreuses provenant de différentes origines : sein, poumon, rein, ovaire, prostate, colon, tissu hématopoiétique (1, 2).
Cependant il n’a pas été rapporté d’études cliniques sur l’efficacité de l’artémisine contre le cancer, et on ne peut s’appuyer que sur des rapports d’observations isolées. L’artémisine agirait selon différents processus (3): mort des cellules cancéreuses (apoptose), inhibition de la prolifération cellulaire cancéreuse, inhibition de l’angiogénèse, freinage de la migration cellulaire cancéreuse.
Le mécanisme d’action se rapproche du mécanisme observé dans le paludisme (4,5) : la molécule d’artémisine est activée en présence de Fer qui ouvre le pont peroxyde, libèrant des radicaux libres qui tuent la cellule cancéreuse. Les cellules cancéreuses sont naturellement riches en Fer (celui-ci est nécessaire pour leur prolifération) et elles sont donc plus sensibles à l’effet cytotoxique de l’artémisine que les cellules normales.
On a pu expérimentalement fixer la molécule d’artémisine sur des molécules de transferrine, porteuses de Fer (6) ; la transferrine est captée par la cellule cancéreuse et la pénètre, introduisant en même temps le Fer et l’artémisine ; dans la cellule le Fer est libéré et l’artémisine l’utilise pour libérer des radicaux libres et tuer la cellule… Le rôle du Calcium a également été mis en évidence (7).
En fait dans la tisane et encore plus dans la poudre de plante entière, l’artémisine n’est pas seule. Il existe de nombreuses autres molécules: les flavonoïdes qui sont présents dans les feuilles d’Artemisia annua, mais également en grandes quantités dans les tiges, et qui ont une action anticancéreuse propre (8,9).
Certains inhibent l’angiogénèse, d’autres comme le limonène inhibent la prolifération cancéreuse. Mais les flavonoïdes ont aussi une action synergique de l’artémisine: Ils sont antioxydants et facilitent l’activation de l’artémisine et la libération des radicaux libres.
L’effet cytotoxique a été retrouvé in vitro sur différentes cultures cellulaires cancéreuses : cancer du sein (10), cancer du poumon (11), lymphocytes (12,13), cancer de la prostate (14).
L’artémisine aurait un effet anti-oestrogénique spécifique, en bloquant les récepteurs oestrogéno sensibles de cultures de cellules tumorales de cancer du sein (15).
En l’absence d’études précises, la posologie n’est pas nettement définie ; on conseille habituellement un litre de tisane par jour, préparé avec une bonne cuillerée à soupe de feuilles, mais il est possible qu’un bol ou une à deux gélules par jour soient suffisants.
1. Efferth T, Dunstan H, Sauerbrey A, Miyachi H, Chitambar CR. The anti-malarial artesunate is also active against cancer. Int J Oncol. 2001 ;18 : 767-73.
2. Efferth T. Antiplasmodial and antitumor activity of artemisinin--from bench to bedside. Planta Med. 2007 ; 73 : 299-309.
3. Firestone GL, Sundar SN. Anticancer activities of artemisinin and its bioactive derivatives. Expert Rev Mol Med. 2009, 30;11: e32.
4. Lai H, Sasaki T, Singh NP. Targeted treatment of cancer with artemisinin and artemisinin-tagged iron-carrying compounds. Expert Opin Ther Targets. 2005 ; 9 : 995-1007.
5. Lai H, Singh NP. Oral artemisinin prevents and delays the development of 7,12-dimethylbenz[a]anthracene (DMBA)-induced breast cancer in the rat. Cancer Lett. 2006 Jan 8;231(1):43-8.
6. Lai H, Sasaki T, Singh NP, Messay A. Effects of artemisinin tagged holotransferrin on cancer cells. Life Sci 2005 ; 76 : 1267-79.
7. Mu D, Zhang W, Chu D, Liu T, Xie Y, Fu E, Jin F. The role of calcium, P38 MAPK in dihydroartemisinin-induced apoptosis of lung cancer PC-14 cells. Cancer Chemother Pharmacol. 2008 ; 61 :
639-45.
8. Ferreira JFS, Luthria DL, Sasaki T, Heyerick A. Flavonoids from Artemisia annua as antioxidants and their potential synergism with artemisinin against malaria and cancer. Molecules 2010, 15,
3135-3170.
9. Efferth T, Herrmann F,Tahrani A, Wink M. Cytotoxic activity of secondary metabolites derived from Artemisia annua L. towards cancer cells in comparison to its designated active constituent artemisinin. Phytomedicine 18 (2011) 959– 969 doi:10.1016/j.phymed.2011.06.008
10. Singh NP, Lai H. Selective toxicity of dihydroartemisinin and holotransferrin toward human breast cancer cells. Life Sci 2001 ; 70 : 49-56.
11. Lu YY, Chen TS, Qu JL, Pan WL, Sun L, Wei XB. Dihydroartemisinin (DHA) induces caspase-3-dependent apoptosis in human lung adenocarcinoma ASTC-a-1 cells. Biomed Sci. 2009 ;16:16.
12. Manuele MG, Ferraro G, Anesini C. Effect of Tilia x viridis flower extract on the proliferation of a lymphoma cell line and on normal murine lymphocytes: contribution of monoterpenes, especially
limonene. Phytother Res. 2008, 22:1520-6.
13. Zhou HJ, Wang Z, Li A. Dihydroartemisinin induces apoptosis in human leukemia cells HL60 via downregulation of transferrin receptor expression. Anticancer Drugs. 2008 ; 19 : 247-55.
14. Thangaiyan R, Anupam B. d-Limonene sensitizes docetaxel-induced cytotoxicity in human prostate cancer cells: Generation of reactive oxygen species and induction of apoptosis. J Carcinog.
2009; 8: 9. Published online 2009 May 21. doi: 10.4103/1477-3163.51368
15. Sundar SN, Marconett CN, Doan VB, Willoughby WA, Firestone GL. Artemisinin selectively decreases functional level of oestrogen receptor-alpha and ablates oestrogen-induced proliferation in human
breast cancer cells. Carconigenesis, 2008 ; 29 : 2252-58.
Dans le cas du paludisme, l’artémisine est active sur les trophozoïtes jeunes (9) et évite l’évolution vers les stades de trophozoïtes plus tardifs, où le parasite adhère à l’endothelium vasculaire ; ce phénomène est appelé séquestration et il se produit dans les microvaisseaux des organes vitaux et notamment du cerveau.
Ce stade de séquestration est considéré comme responsable des complications de l’accès palustre et notamment du neuropaludisme, avec adhérence des hématies parasitées à la paroi des veinules postcapillaires du cerveau, inflammation et hémorragies autour des vaisseaux, le coma étant dû à l’accumulation dans les capillaires cérébraux d’un grand nombre d’hématies parasitées, responsables de troubles métaboliques par production de toxines.
Plus tard dans le cycle du Plasmodium, l’artémisine pénètre dans les globules rouges parasités et stoppe précocément la maturation des schizontes, empêchant leur maturation et la libération des mérozoites dans le sang.
Navaratnam (10) a constaté que la fixation des dérivés d’artémisine est 150 fois plus importante sur les hématies infectées que sur les hématies saines. Ceci explique qu’un faible taux plasmatique d’artémisine soit efficace.
L'artémisine a également un effet gamétocytocide supérieur aux antipaludéens classiques (Okell, 11), diminuant ainsi le risque de transmission du parasite de l'homme au moustique. Cet effet gamétocytocide est de grande importance, car les gamétocytes peuvent persister dans le sang de façon latente, en particulier chez l'enfant, qui peut rester contagieux longtemps après la guérison de l'accès palustre (Barnes,12).
Le mode d’action de l’artémisine reste encore incomplètement connu. Plusieurs mécanismes semblent s’associer (13). Certains sont spécifiques : perturbation dans le métabolisme des protéines du parasite et perturbation de l’activité mitochondriale du parasite. D’autres sont non spécifiques, notamment un effet sur le système immunitaire et un rôle d’inhibition de l’angiogénèse.
1) Perturbation dans le métabolisme des protéines du parasite.
Le mécanisme fondamental serait l’inhibition d’un enzyme, la Ca++ATPase qui intervient dans la synthèse des protéines des membranes cellulaires du parasite (14).
La Ca++ATPase est présente dans le réticulum endoplasmique du parasite ; elle assure le maintien de la concentration en ions Ca++ dont le rôle est fondamental pour la synthèse des protéines. L’artémisine se fixerait sur la Ca++ATPase en laissant disponible le pont peroxyde ; celui-ci est rompu en présence d’ions Fe++ (car le Fer attire un électron de l’oxygène). Les atomes d’oxygène sont alors activés et ils attirent des ions H+, libérant ainsi des radicaux libres de carbone. Ces radicaux libres inhibent l’ATPase, ce qui entraine la mort du parasite.
Le Fer semble provenir de l’hème, c’est-à-dire du produit de dégradation de l’hémoglobine consécutive à l’infestation des globules rouges par le parasite. Cet hème est libéré en grandes quantités et son accumulation génère des radicaux d’oxygène toxiques pour le parasite. Le parasite évite ces effets toxiques en polymérisant les molécules d’hème en un composant non toxique, l’hémozoine. L’artémisine semble inhiber la formation de l’hémozoine dans les vacuoles du parasite, entrainant sa destruction (15).
Ainsi l’hème intraparasitaire activerait l’artémisine et libèrerait les radicaux libres de carbone dans le parasite, ce qui peut expliquer la toxicité sélective de l’artémisine sur le parasite (Meshnick, 16).
Mais il est possible que le Fer ait également une autre origine, car l’artémisine agit précocément dans le cycle parasitaire, avant la dégradation de l’hémoglobine.
Par ailleurs l’artémisine est retrouvée également dans les structures membraneuses du parasite (reticulum endoplasmique, système mitochondrial), et non pas uniquement dans les vacuoles cytoplasmiques où se trouve l’hème, ce qui suggère d’autres mécanismes d’action.
2) Perturbation de l’activité mitochondriale du parasite.
Le système mitochondrial est nécessaire pour la chaîne respiratoire du parasite (apport d’oxygène) et pour sa croissance. L’artémisine serait activée par le fer contenu dans la mitochondrie, selon le processus décrit ci-dessus ; les atomes d’oxygène du pont peroxyde ainsi activés perturberaient le transport des électrons dans la mitochondrie, provoquant une dépolarisation de la membrane mitochondriale. Ceci empêche la biosynthèse des protéines nucléiques du parasite, et notamment de la pyrimidine, aboutissant à la mort du parasite (Maeno,17).
3) Rôle d’inhibition de l’angiogénèse :
Il s’agit de la prolifération cellulaire inflammatoire réactionnelle à l’agression du parasite qui adhère à l’endothélium vasculaire, en particulier au niveau des petits vaisseaux (phénomène de la séquestration). L’artémisine aurait un effet favorable sur l’œdème et les hémorragies liées à l’inflammation vasculaire. Cet effet est particulièrement bénéfique car il atténue la sévérité du paludisme cérébral.
Références
1. Jansen FH., Soomro, Shahid A. Chemical Instability Determines the Biological Action of the Artemisinins. Current Med Chemistry 2007, 14: 3243-59.
2. Houzé S, Munier A, Paoletti X, Kaddouri H, Ringwald P, Le Bras. Shelf Life of Predosed Plates Containing Mefloquine, Artemisinin, Dihydroartemisinin, and Artesunate as Used for In Vitro Plasmodium falciparum Susceptibility Assessment. J Clin Microbiol 2007, 45: 2734-36.
3. Lubbe A, Seibert I, Klimkait T, van der Kooy F. Ethnopharmacology in overdrive : the remarkable anti-HIV activity of Artemisia annua. J Ethnoparmacol, (2012), doi:10.1016/j.jep.2012.03.024
4. Lutgen P, Michels B. Bactericidal properties of Artemisia annua tea and dosimetry of artemisinin in water by fluorescence under UV light. Proceedings of the Internation al Conference “Maladies Tropicales, aspects humanitaires et économiques”, Luxembourg, June 3-4 2008. In Revue Technique Luxembourgeoise, 2008, 2 ; 73-78.
5. Sen R, Bandyopadhyay S, Dutta A, Mandal G, Ganguly S, Saha P, Chatterjee M. Artemisinin triggers induction of cell-cycle arrest and apoptosis in Leishmania donovani promastigotes. J Med Microbiol 2007, 56 : 1213-8
6. Ferreira JFS, Luthria DL, Sasaki T, Heyerick A. Flavonoids from Artemisia annua as antioxidants and their potential synergism with artemisinin against malaria and cancer. Molecules 2010, 15, 3135-3170.
7. Krishna S, Bustamante L, Haynes R K, Staines H M. Artemisinins: their growing importance in medicine. Trends Pharmacol Sci. 2008 October; 29(10): 520–527.
8. Nakase I, Lai H, Singh NP, Sasaki. T Anticancer properties of artemisinin derivatives and their targeted delivery by transferrin conjugation. Int J Pharm. 2008 Apr 16;354(1-2):28-33.
9. Agtmael (van) MA, Eggelte TA Boxtel (van) CJ. Artemisinin drugs in the treatment of malaria : from medicinal herb to registered medication. Trends Pharmacol Sci 1999 ; 20 : 199-205.
10. Navaratnam V, Mansor SM, Sit NW, Grace J, Li Q, Olliaro P. Pharmacokinetics of artemisinin-type compounds. Clin Pharmacokinet. 2000 Oct;39(4):255-70. Review.
11. Okell LC, Drakeley CJ, Ghani AC, Bousema T, Sutherland CJ. Reduction of transmission from malaria patients by artemisinin combination therapies: a pooled analysis of six randomized trials. Malaria Journal 2008, 7:125.
12. Barnes KI, White NJ. Population biology and antimalarial resistance: The transmission of antimalarial drug resistance in Plasmodium falciparum. Acta Trop 2005 ; 94: 230-40).
13. Golenser J, Waknine JH, Krugliak M, Hunt NH, Grau GE. Current perspectives on the mechanism of action of artemisinins. Int J Parasitol 2006, 36 : 1427-1441.
14. Eckstein-Ludwig U, Webb RJ, I. van Goethem DA, East JM, LeeAG, Kimura M, O’Neill PM, Bray PG, Ward SA, Krishna S. Artemisinins target the SERCA of Plasmodium falciparum. Nature 2003, 424 : 957-61.|
15. Akkawi M, Jaber S, Abu-Remeleh Q, Engeu OP, Lutgen P (2014) Investigations of Artemisia Annua and Artemisia Sieberi Water Extracts Inhibitory Effects on β-Hematin Formation. Med Aromat Plants 3: 150. doi: 10.4172/2167-0412.1000150.
16.Meshnick SR. Artemisinin: mechanisms of action, resistance and toxicity International Journal for Parasitology 32 (2002) 1655–1660.
17. Maeno Y, Toyoshima T, Fujioka H, Ito Y, Meshnick SR, Benakis A, Milhous WK, Aikawa M. Morphologic effects of artemisinin in Plasmodium falciparum. Am J Trop Med Hyg. 1993, 49 ; 485-91.
L’EFFICACITE DE L’ARTEMISIA ANNUA
L’action antipaludéenne de l’Artemisia annua est multiple : elle possède un effet répulsif sur les moustiques, lié plus à la présence de terpénoides que d’artémisine, et que l’on peut exploiter par fumigation ou simplement en la faisant pousser à proximité des habitations. Elle a également un effet parasitocide direct, lié aux multiples composants présents dans la plante. On trouve dans la littérature de très nombreux travaux consacrés à l’artémisine elle-même ou à ses dérivés semi-synthétiques. Actuellement on trouve également de nombreux travaux consacrés aux autres molécules présentes dans l’Artemisia annua, molécules dont le pouvoir antipaludéen se confirme de plus en plus. L'ensemble de ces molécules constitue le « totum », dont l’effet thérapeutique est supérieur à celui des composants pris isolément.
1. L’ARTEMISINE
1.1. Le taux d’artémisine contenu dans les feuilles
dépend de plusieurs facteurs, et notamment de la variété d’Artémisia annua, du moment de la récolte, du mode de séchage, de la durée de conservation, et surtout du mode de conservation des feuilles qui semble avoir un rôle prépondérant. Les concentrations relevées dans la littérature varient entre 0,10% et 1%.
A Madagascar le taux observé est de 0,5%. Au Sénégal différentes variétés ont été étudiées, parmi lesquelles les variétés brésilienne, Anamed et Médiplant. Dans toutes ces variétés le taux était supérieur à 0,8%, allant jusqu’à 1,3% dans la variété Mediplant. La concentration était de 0,63% à 0,70% dans l’expérimentation de Mueller (1).
Les feuilles situées à la partie supérieure du plant sont plus riches en artémisine (2). L’hybridation de l’Artémisia annua semble beaucoup augmenter la concentration en artémisine. Dans l’étude de Jiang (3) la concentration en artémisine était de 0,90% dans de l’artémisia annua naturelle et de 1,45% dans de l’artémisia annua transgénique.
Cependant l’hybridation compromet la production de graines. Enfin une fertilisation avec le phosphore pourrait avoir un rôle favorable en augmentant la concentration en artémisine (4).
Si la concentration en artémisine présente un intérêt pour la commercialisation, elle n’est cependant pas un facteur fondamental pour le pouvoir antipaludéen de l’Artémisia annua, et l’hybridation ne semble pas à recommander pour l’utilisation thérapeutique de la plante : Gueye (5) retrouve in vitro une efficacité identique avec de la tisane à base de feuilles brésiliennes à concentration voisine de 1% et avec de la tisane à base de feuilles luxembourgeoises, dans lesquelles la concentration n’est que de 0,1 à 0,2% ; il explique cela par la présence d’autres molécules dans la tisane.
Lubbe (6) retrouve in vitro une activité identique avec Artémisia annua et Artémisia afra, qui ne contient pas d’artémisine. De même, dans l’étude de Malagon (7) la reproduction du plasmodium est inhibée à plus de 98% par Artémisia ludoviciana mexicana, qui ne contient pas d’artémisine.
1.2. La quantité de feuilles recommandée
pour la préparation en tisane est de 9 à 10 grammes de feuilles pour un litre d’eau bouillante ; cependant Mueller (8) et Blanke (9) ont utilisé une infusion contenant 5 grammes de feuilles avec des résultats cliniques identiques. Il semble préférable de verser l’eau bouillante sur les feuilles et non pas de jeter les feuilles dans l’eau ; il ne faut pas poursuivre l’ébullition avec les feuilles, car cela détruit l’artémisine : dans les expérimentations de Räth (10) et Mueller (1), la concentration en artémisine est deux à trois fois moins importante lorsque la tisane est maintenue à ébullition (de 5 à 30 minutes).
Il faut si possible utiliser un récipient en plastique ou mieux en verre pour faire infuser, et éviter un récipient en fer (le fer réagissant avec l’artémisine). Après avoir versé l’eau bouillante sur les feuilles, Räth conseille de remuer le mélange (avec une cuiller en bois), puis de laisser infuser 10 minutes, le récipient étant recouvert ; il faut ensuite filtrer la tisane, presser les feuilles pour récupérer les reliquats d’artémisine dissoute, et enfin laisser refroidir la tisane.
Avec ce protocole, Räth obtient une quantité d’artémisine de 94,5 mg/l avec 9 g de feuilles et de de 60 mg/l avec 5 g de feuilles. Avec un protocole similaire, Mueller obtient 12 mg/l d’artémisine avec 5 g de feuilles, 24 mg/l avec 10 g, 32 mg/l avec 20 g, et 64 mg/l avec 40 g de feuilles. Rocha e Silva (11) obtient 40-46 mg avec 5g/l de feuilles. Jansen (12) a mesuré 24,2 mg/l. Selon Mueller 40% de l’artémisine présente dans les feuilles peut être extraite dans la tisane, ce qui représente 40 mg si l’on considère une concentration de 1% dans une quantité de 10 g de feuilles.
La dose quotidienne d’artémisine ou de ses dérivés recommandée par l’OMS est de 20 mg/kg le premier jour, puis de 8 à 10 mg/kg durant les 6 jours suivants, soit pour un adulte de 60 kg une 1200 mg le premier jour puis 600 mg les jours suivants (13).
Ces doses sont très supérieures à la quantité d’artémisine extraite de 5 grammes de feuilles en tisane (de l’ordre de 20 mg à 50 mg), et on peut considérer que l’apport en artémisine par l’ingestion de tisane est très insuffisant. Cependant la posologie « officielle » ne repose sur aucune étude argumentée ; de même la quantité de feuilles habituellement conseillée (9g/l) est arbitraire et peut parfaitement être augmentée ou diminuée.
Ashton (14) a même constaté une efficacité identique dans une étude comparant l’artémisine administrée aux mêmes doses par voie orale et par voie rectale, bien que le coefficient d’absorption de cette dernière voie soit nettement inférieur à celui de la voie orale. Tout ceci suggère qu’une dose quotidienne de 600 mg est probablement excessive et donc inutile.
On sait que l’artémisine est peu soluble dans l’eau, et le bon rendement obtenu avec la préparation en tisane s’explique par la présence dans les feuilles d’autres constituants (flavonoïdes, saponines, polysaccharides…) qui favoriseraient la dissolution de l’artémisine en agissant comme détergents (15), ou avec lesquels l’artémisine pourrait former des complexes hydro-solubles.
1.3. La concentration plasmatique maximum :
Après absorption de 500 mg d’artémisine extraite (sous forme de comprimés), la concentration maximum est obtenue très rapidement, entre 2 et 3 heures, et elle dépasse le plus souvent 200 microgr/l (16).
Elle était de 615 mg/l dans l’étude de Alin (17) ; elle était de 391 mg/l dans l’étude faite par Duc (18) et de 364 mg/l dans le travail de Vries (19).
Après absorption d’une tisane contenant 9 g de feuilles d’Artémisia annua (soit environ 30 à 40 mg d’artémisine), Räth (10) a noté que la concentration plasmatique maximum était de 240 mg/l. Cette concentration élevée suggère que l’artémisine naturelle présente dans la tisane est mieux absorbée que l’artémisine en comprimés.
Il faut insister sur le fait que la tisane contient d’autres composés que l’artémisine, qui augmentent probablement son absorption.
Dans l'étude de Vries (19), la concentration en artémisine efficace in vitro pour inhiber 50 % de croissance du plasmodium falciparum (IC50) est de 3 à 30 mg/l ; selon Alin (20) et Heide (21) elle est de 10 mg/l. La concentration plasmatique mesurée après ingestion de tisane est donc très supérieure à ces chiffres.
In vitro, Alin a constaté que la croissance du Plasmodium était inhibée à raison de 63% après 3 heures d’exposition à l’artémisine, l’inhibition atteignant 95% après un délai de 48 heures. In vivo, le temps nécessaire à l’élimination du parasite est d’environ 36 heures: il était de 26 heures dans l’étude de Alin (22), de 48 heures dans l’étude de Mueller (1), et de 36 heures dans l’étude de de Vries (19).
Ainsi le traitement par artémisine est presque immédiatement efficace ; il permet de réduire considérablement la concentration en parasites, pratiquement au-dessous des valeurs détectables, mais sans élimination totale, et la croissance des quelques parasites restants expose à une récidive précoce de la parasitémie et surtout à une récidive clinique de l’accès palustre.
Ce risque, ajouté au fait que la durée de vie de l’artémisine est courte, avec une demi-vie moyenne de 2 heures et demie à trois heures (17,18,19), nécessite de prolonger pendant au moins 5 jours le traitement par tisane (23) ; la durée habituellement recommandée est de 7 jours.
Cette brièveté de la demi-vie de l'artémisine est d’ailleurs considérée par certains comme un élément favorable, le parasite n'ayant pas le temps de développer de résistance.
On trouve cependant dans la littérature une étude comparative moins optimiste (Atemnkeng,24) effectuée sur des souris, étude dans laquelle la parasitémie au 4ème jour était de 50 % dans le groupe traité par tisane, contre 3 % dans un groupe traité par artésunate ; par ailleurs toutes les souris traitées par tisane étaient décédées au 11ème jour alors que 83 % des souris traitées par artésunate étaient survivantes.
1.4. L’efficacité clinique de la tisane
de feuilles d’Artemisia annua dans le traitement du paludisme a été démontrée à l’occasion du traitement de plusieurs cas isolés (communications personnelles), tous avec une rapide et complète amélioration clinique. L’efficacité de la tisane a également été étudiée dans quelques séries randomisées de la littérature:
Chougouo Kengne (25) rapporte une étude comparant tisane et artésunate seul ou associé à amodiaquine, mais sans que soit nettement précisé le matériel d'étude: le taux d'échecs était de 0 % en cas de traitement par la tisane durant 7 jours, mais de 28 % en cas de traitement durant 5 jours ; il était de 12 % et 14 % avec l'artésunate seul ou associé a l'amodiaquine.
Dans un travail plus récent (26), le même auteur analyse une série de 49 enfants âgés de 6 mois à 10 ans, traités par de la tisane au goût adouci par adjonction de stevia. La parasitémie moyenne a chuté de 1860 à 35 (à J+2) et à 0 (à J+3).
Dans une étude récente portant sur 3000 cas, dont 250 enfants âgés de moins de 5 ans, Willcox (27) rapporte une efficacité constante de la tisane, sans effets secondaires notables chez les enfants ni chez les femmes enceintes (24 cas traités durant le premier trimestre de gestation).
Par contre l’auteur signale des difficultés dans la culture de l’Artemisia annua dans près de la moitié des cas (au Kenya et en Ouganda). Fouda (28) rapporte une étude brésilienne portant sur 72 patients traités par tisane (1 litre/jour avec 5g de feuilles pendant 7 jours) : le pourcentage d’éradication du parasite dans le sang était de 4,3% à J+1, de 47,7% à J+2, de 85,9% à J+7, et de 93,7% à J+14. Blanke (9) rapporte 10 cas traités par tisane ; Mueller (1,8) rapporte deux séries, l’une de 53 patients, l’autre de 72 patients.
Dans ces dernières études une importante amélioration clinique a été observée dans presque tous les cas dès le troisième jour du traitement. Dans les trois études la parasitémie avait disparu dans 70% des cas au 7ème jour. Tiruneh (29) évalue une série de 473 patients et constate une guérison de l’accès palustre dans 92% des cas.
L’ensemble des auteurs a noté une récidive de la parasitémie au 28ème jour dans un nombre variable de cas, allant de variant selon les séries de 18% à 90%.
Ces cas de réapparition de la parasitémie ont souvent été considérés comme des échecs, même en l’absence de récidive de la symptomatologie clinique.
Cependant la constatation d’une parasitémie modérée sans symptomatologie clinique est habituelle chez l’enfant en zone d’endémie, et il est admis que cela lui apporte une immunité relative et assure une protection minimale contre les infections ultérieures à l’âge adulte.
Selon l'étude de Bottius (30) qui porte sur une population en zone d'endémie, 50 % des sujets testés présentaient une parasitémie microscopique, mais le chiffre s'élevait à 90 % avec des techniques plus sensibles (polymerase chain reaction). Dans une étude récente portant sur 25 enfants, nous avons retrouvé une parasitémie dans 100% des cas (31). Ainsi une parasitémie isolée notée après traitement d’un accès palustre ne parait pas très significative et plusieurs publications ont souligné ce fait : Mueller (1), Silachamroon (32), Swarthout (33), Whitty (15) ont retrouvé entre la 4ème et la 6ème semaine une parasitémie variable de 20% à 50% selon les dérivés d’artémisine utilisés, isolément ou en combinaison. Au recul de 6 semaines, il est d’ailleurs difficile d’attribuer cette parasitémie à une récidive (donc à un échec du traitement) ou à une réinfestation (la distinction nécessiterait une étude génotypique du parasite). Dans l’étude très complète de Ashley (34) portant sur une population de 2926 enfants traités par ACT, une récurrence de la parasitémie a été observée dans 942 cas entre le 14ème et le 28ème jour, attribuée à une récidive dans 12% des cas et à une réinfestation dans 78% des cas, avec un taux d’échecs variant de 0% à 40% selon la méthodologie statistique utilisée. Farnert (35) constate une très grande variation de la densité (fluctuant de 0 à 790) et des stades de maturation du parasite chez le même patient évalué toutes les 6 heures pendant 5 jours.
2. LES FLAVONOIDES
Les très nombreuses recherches qui ont été effectuées après l’isolement de la molécule d’artémisine sont restées centrées sur cette molécule, qui a été considérée sans doute à tort comme la seule molécule efficace contre le paludisme.
On sait maintenant que l’Artemisia Annua contient en outre un véritable cocktail de molécules de flavonoïdes (scopolétine, casticine, chrysoplenetine, chrysosphenol-D, cirsilineol…) (38,39).
Ces flavonoïdes se trouvent dans les feuilles, mais également et peut-être à concentration plus importante dans les tiges de la plante (40). Les flavonoïdes résistent mal à l’extraction par l’eau bouillante (à la différence de l’artémisine) (41).
Quelques auteurs (44) ne retrouvent pas d’efficacité statistiquement différente entre l’artémisine en tisane et l’artémisine pure ; néammoins, de nombreux travaux récents accordent une grande importance à l’association artémisine et flavonoïdes.
A doses faibles ces molécules, comme notamment la quercetine, potentialisent l’action de l’artémisine, peut-être en inhibant des enzymes destructeurs de l’artémisine (45).
Ashton (46) avait observé que, avec un traitement quotidien continu par artémisine pure, la concentration plasmatique en artémisine diminue avec le temps, passant à 34% au 4ème jour de traitement et à 24% au 7ème jour de traitement, et il évoquait la possibilité de l’induction par l’artémisine de la production d’enzymes auto-destructeurs (cette diminution de la concentration plasmatique en artémisine peut d’ailleurs expliquer la récidive de la parasitémie qui s’observe dans 2% à 50% des cas au 28ème jour après un traitement par artémisine seule). Selon Selon Ferreira (45) ces enzymes (et notamment le CYP450) sont détruits par les flavonoides présents dans l’Artemisia annua. Les flavonoides favoriseraient ainsi l’efficacité des molécules d’artémisine qui resteraient actives plus longtemps dans l’organisme. De plus les flavonoides auraient une action synergique de l’artémisine, en favorisant la pénétration de l’artémisine à travers les membranes cellulaires du parasite. Enfin, certaines molécules (l’acide rosmarinique) ont une puissante action anti-inflammatoire au niveau intestinal, synergique de l’effet antipaludéen de l’artémisine (47).
A doses fortes les flavonoïdes ont une action antipaludéenne directe sur le Plasmodium falciparum (48,49)
Certains flavonoïdes (quercetine, luteoline, apigenine) (50) inhibent précocément la croissance du Plasmodium Falciparum dont le développement est stoppé au stade de trophozoïte intraérythrocytaire, de même que le 1,8 cineole (51). Les terpènes comme le limonène ou le farnesol inhibent également le développement du Plasmodium Falciparum par leur pouvoir anti-oxydant (52,53).
Enfin, on accorde actuellement un rôle important aux polysaccharides présents dans l’Artemisia annua (49). Ils favoriseraient la solubilité de l’artémisine et des flavonoïdes. Ils ont un effet anti-inflammatoire. De plus les polysaccharides sulfatés présents dans l’Artemisia annua empêcheraient l’invasion des érythrocytes par le parasite à un stade précoce de mérozoite.
A l’inverse, les monosaccharides, ou sucres simples (glucose, lactose), semblent à déconseiller car ils favoriseraient le développement du parasite, qui en a besoin pour son métabolisme.
L’addition de sucre ou de miel dans la tisane, qui a été suggérée pour diminuer l’amertume de la tisane et la rendre plus acceptable pour les enfants, est donc peut-être à déconseiller, mais reste très utile dans la pratique…
Le traitement par l’Artemisia annua n’est donc pas une monothérapie, mais plutôt une véritable polythérapie, et peut-être les recherches ont-elles négligé ces différentes molécules au profit de l’artémisine elle-même. Cette polythérapie peut expliquer certains paradoxes entre l’utilisation de l’artémisine pure et l’utilisation des extraits d’Artemisia annua :
- Les doses d’artémisine dans la tisane sont très inférieures aux doses recommandées en cas de traitement par l’artémisine elle-même, et pourtant les résultats sont au moins aussi bons.
- On a montré que la molécule d’artémisine est très peu soluble dans l’eau, et pourtant 40% de l’artémisine présente dans les feuilles est retrouvée dans la tisane.
- Le plasmodium falciparum a développé une résistance à l’artémisine ou à ses dérivés, même associés à des molécules à action plus lente (54,55). Les premiers cas de résistance ont été observés au Cambodge avec l’artésunate (56) ; elle a été expliquée par la persistance d’une gamétocytémie élevée en fin de traitement par dérivés de l’artémisine (artésunate et arthémeter) (57), dont l’action gamécytocide est peu importante. A l’inverse il n’a pas été signalé de cas de résistance après traitement par tisane. La polythérapie de la tisane peut expliquer que le plasmodium falciparum ne soit pas devenu résistant à l’artémisine, malgré deux millénaires d’utilisation de la tisane. L’efficacité d’une polythérapie par rapport à une simple molécule pour limiter l’apparition de résistance a été prouvée expérimentalement notamment sur des graines de Neem (58).
- La teneur en artémisine est très variable selon les souches d’Artemisia annua, de 0,1 % à plus de 1 % pour la variété brésilienne (la teneur en artémisine de l’Artemisia annua produite par ACP est de l’ordre de 0,50%), et pourtant les résultats dans le traitement de l’accès palustre sont équivalents.
Ainsi la polythérapie présente plusieurs avantages. Les différents composants ont un effet synergique comme le confirme le travail de Gueye (59), qui teste in vitro l’efficacité de la tisane et constate une IC 50 de 0.095 μg/ml. De même, de Donno (60) calcule que l’efficacité de la tisane est trois fois plus importante que ne le serait la même quantité d’artémisine prise isolément.
La tendance actuelle est d’administrer l’Artemisia annua non pas sous forme de tisane, qui n’apporte que les composants qui sont solubles et dissous dans l’eau, mais d’administrer la plante pulvérisée, soit en gélules, soit sous forme de comprimés, soit encore sous forme de poudre mélangée à yaourt, confiture, bouillie…
Ceci a l’avantage d’apporter la totalité de la plante (le Totum), avec donc une efficacité accrue. L’administration sous forme de gélules a été testée dès 1992 en Chine : dans une étude réalisée en 1992 (61), le traitement par gélules était 3,5 fois plus efficace que le traitement par artémisine pure pour l’élimination du parasite.
Le récent travail de Elfawal et al (62) est également très démonstratif: chez des souris ayant reçu de la plante sèche, l’absorption d’artémisine est 40 fois supérieure à celle observée chez des souris ayant reçu la quantité correspondante d’artémisine pure.
Avec une dose de 24 mg/kg (plante sèche), les auteurs obtiennent une chute quasi-totale de la parasitémie 30 heures après l’ingestion.
Au cours d’une mission chirurgicale en Centrafrique, nous avons nous-mêmes traité préventivement durant deux jours et demi 25 enfants en bonne santé qui devaient être opérés de lésions orthopédiques, par une dose quotidienne de 400 à 500 mg de poudre d’Artémisia annua administrée en gélules, soit environ 16 mg/kg (29) : nous avons constaté qu’après 36 heures, la parasitémie (présente dans tous les cas) avait diminué de 65%.
Dans cette expérience, la dose quotidienne d’artémisine administrée était très faible, de l’ordre de 0,4 à 0,5 mg d’artémisine, et sans doute inefficace à elle seule.
Ces résultats sont également concordants avec ceux observés dans l’étude de l’International Centre of Insect Physiology and Ecology (63) dans laquelle 47 patients ont été traités par pilules de 500 mg d’Artemisia annua pendant 6 jours : la parasitémie qui était positive dans tous les cas au début du traitement était nulle dans près de 90% des cas entre le 3ème et le 5ème jour.
Enfin dans un récent travail, Weathers a constaté que la pulvérisation de feuilles sèches ne modifie pas la concentration en artémisine, et que la teneur en flavonoïdes était multipliée par cinq (64).
Tous ces résultats confirment l’intérêt de l’administration de la plante entière : absorption plus rapide et plus complète de l’artémisine, inhibition d’enzymes digestifs et hépatiques destructeurs de l’artémisine, synergie antiparasitaire entre artémisine et flavonoïdes, et enfin effet antipaludéen propre des flavonoïdes
Références
1. Mueller MS, Karhabomga IB, Hirt HM, Wemakor E. The potential of Artemisia annua L. as a locally produced remedy for malaria in the tropics: agricultural, chemical and clinical aspects. J Ethnopharmacol 2000, 73 : 487-93.
2. Ogwang PE, Ogwal J O, Kasasa S, Ejobi F, Kabasa D, Obua C.Use of Artemisia annua L. Infusion for Malaria Prevention: Mode of Action and Benefits in a Ugandan Community. British J of Pharm Research, 2011, 1: 124-132.
3. Jiang L, Liu H, Wang J, Tan F, Zhao K, Wu X, Zhu H, Tang K, Tang X. Characterization and comparison of three transgenic Artemisia annua varieties and wild-type variety in environmental release trial. Journal of Medicinal Plants Research, 2010, Vol. 4 : 2719-28.
4. Kapoor R, Chaudhary V, Bhatnagar AK. Effects of arbuscular mycorrhiza and phosphorus application on artemisinin concentration in Artemisia annua L. Mycorrhiza 2007, 17 : 581-7.
5. Gueye Papa O. (Etude clinique sur l’efficacité thérapeutique de l’Artemisia annua sur l’accès palustre simple (à paraitre).
6. Lubbe A, Seibert I, Klimkait T, van der Kooy F. Ethnopharmacology in overdrive : the remarkable anti-HIV activity of Artemisia annua. J Ethnoparmacol, (2012), doi:10.1016/j.jep.2012.03.024
7. Malagon F, Vazquez J, Delgando G, Ruiz A. Antimalaric effect of an alcoholic extract of Artemisia ludoviciana mexicana in a rodent malarial model. Parasitemia, 1997, 39 : 3-7.
8. Mueller MS, Runyambo N, Wagner I, Borrmann S, Dietz K, Heide L. Randomized controlled trial of a traditional preparation of Artemisia annua L. (Annual Wormwood) in the treatment of malaria. Trans R Soc Trop Med Hyg 2004, 98 : 318-21.
9. Blanke CH, Naisabha GB, Balema MB, Mbaruku GM, Heide L, Müller SM. Herba Artemisia annuae tea preparation compared to sulfadoxine-pyrimethamine in the treatment of uncomplicated falciparum malaria in adults: a randomized double-blind clinical trial. Trop Doct 2008, 38 :113-6.
10. Räth K, Taxis K, Walz G, Gleiter CH, Li SM, Heide L. Phamacokinetic study of artemisinin after oral intake of a traditional preparation of Artemisia annua L. (annual wormwood). Am J Trop Med Hyg 2004, 70: 128-32.
11. Rocha e Silva LF, Melillo de Magalhães P, Farias Costa MR, Graças Costa Alecrim (das) M, Maia Chaves FC, Freitas Hidalgo (de) A, Pohlit AM, Ribeiro Vieira PP. In vitro susceptibility of Plasmodium falciparum Welch field isolates to infusions prepared from Artemisia annua L. cultivated in the Brazilian Amazon. Mem Inst Oswaldo Cruz, Rio de Janeiro, 2012 ; 107: 859-866.
12. Jansen FH. The herbal tea approach for artemisinin as a therapy for malaria? Trans R Soc Trop Med Hyg 2006, 100 : 285-6.
13. Willcox M, Bodeker G, Bourdy G, Dhingra V, Falquet J, Ferreira J F, ... & Wright C W (2004). Artemisia annua as a traditional herbal antimalarial. Traditional Medicinal Plants and Malaria, 43-59.
14. Ashton M, Nguyen DS, Nguyen VH, Gordi T, Trinh NH, Dinh XH, Nguyen TN, Le DC. Artemisinin kinetics and dynamics during oral and rectal treatment of uncomplicated malaria. Clin Pharmacol Ther 1998; 63: 482-13.
15. Whitty CJ, Staedke SG. Artemisinin-based combination treatment for malaria in Africa: no perfect solutions. Clin Infect Diseases 2005, 41: 1087-88.
16. Malagon F, Vazquez J, Delgando G, Ruiz A. Antimalaric effect of an alcoholic extract of Artemisia ludoviciana mexicana in a rodent malarial model. Parasitemia, 1997, 39 : 3-7.
17. Alin MH, Ashton M, Kihamia CM, Mtev GJ, Björkman A. Clinical efficacy and pharmacokinetics of artemisinin monotherapy and in combination with mefloquine in patients with falciparum malaria. Br J Clin Pharmacol 1996; 41 : 587-92.
18. Duc DD, Vries (de) PJ, Nguyen XK, Le Nguyen B, Kager PA, Boxtel (van) CJ. The pharmacokinetics of a single dose of artemisinin in healthy Vietmanese subjects. Am J Trop Med Hyg 1994, 51 : 785-90.
19. Vries (de) PJ, Tran KD, Nguyen XK, Le Nguyen B, Pham TY, Dao DD, Boxtel (van) CJ, Kager PA. The pharmacokinetics of a single dose of artemisinin in patients with uncomplicated falciparum malaria. Am J Trop Med Hyg 1997, 56 : 503-7.
20. Alin MH, Björkman A. Concentration and time dependency of artemisinin efficacy against Plasmodium falciparum in vitro. Am J Trop Med Hyg 1994 ; 50 : 771-76.
21. Heide L, Artemisinin in traditional tea preparations of Artemisia annua. Trans R Soc Trop Med Hyg 2006, 100 : 802.
22. Alin MH, Ashton K, Kihamia CM, Mtey GJ, Björkman A. Multiple dose pharmacokinetics of oral artemisinin and comparison of its efficacy with that of oral artesunate in falciparum malaria patients. Trans R Soc Trop Med Hyg 1996, 90 : 61-5.
23. Le NB, Pham TY, Nguyen BN, Dang CT, Pham TL, Le DC. Efficacy and effectiveness of five days treatment of uncomplicated falciparum with artemisinin or artesunate in Vietnam. Southeast Asian J Trop Med Public Health 1999, 30: 3-6.
24.Atemnkeng MA, Chimanuka B, Dejaegher B, Heyden YV, Plaizier-Vercammen J. Evaluation of Artemisia annua infusion efficacy for the treatment of malaria in Plasmodium chabaudi chabaudi infected mice. Exp Parasitol. 2009, 122:344-8.
25. Chougouo RD, Kouamouo J, Moyou Somo R, Penge On’Okoko A. Comparative study of the quality and efficiency or artemisinin drug based and Artemisia annua grown in Cameroon. 5th MIM (Multilateral Initiative on Malaria) Pan-African Malaria Conference, 2-6 Novembre 2009, Nairobi, Kenya.
26. Chougouo RD, Ketchiozo W, Kouamouo J, Lutgen P, Tane P, Moyou R. Efficacy and tolerancy of Artemisia annua lemonade in treatment of Plasmodium falciparum malaria of children between 6 months and 10 years at Bahouoc and Bangang Fokam (Cameroun). 6th MIM Pan-african Malaria conference, 6-11 October 2013, Durban, South Africa.
27. Willcox M L, Burton S, Oyweka R, Namyalo R, Challand S, Lindsey K. Evaluation and pharmacovigilance of projects promoting cultivation and local use of Artemisia annua for malaria. Malaria Journal 2011, 10:84 doi:10.1186/1475-2875-10-84.
28. Fouda. Etude clinique sur l’efficacité thérapeutique de l’artemisia annua sur l’accès palustre simple. communication à Yaoundé, 5 01 2010.
29. Tiruneh G, Kebede Y, Yigzaw T. Use of the plant artemisia annua as a natural anti-malarial herb in arbaminch town Ethiop. J. Health Biomed Sci., 2010, 2, 75-82.
30. Bottius E, Guanzirolli A, Trape JF, Rogier C, Konate L, Druilhe P. Malaria: even more chronic in nature than previously thought; evidence for subpatent parasitaemia detectable by the polymerase chain reaction. Trans R Soc Trop Med Hyg. 1996, 90:15-9
.
31. Onimus M, Carteron S, Lutgen P (2013) The Surprising Efficiency of Artemisia annua Powder Capsules. Med Aromat Plants 2: 125. doi:10.4172/2167- 0412.1000125.
32. Silachamroon U, Phumratanaprapin W, Krudsood S, Treeprasertsuk S, Budsaratid V, Pornpininworakij K, Wilairatan P, Looareesuwan S. Frequency of early rising parasitaemia in falciparum malaria treated with artemisinin derivatives. Southeast Asian J Trop Med Public Health 2001, 32 : 50-6.
33. Swarthout TD, van den Broek IV, Kayembe G, Montgomery J, Pota H, Roper C. Artesunate + amodiaquine and artesunate + sulphadoxine-pyrimethamine for treatment of uncomplicated malaria in Democratic Republic of Congo: a clinical trial with determination of sulphadoxine and pyrimethamine-resistant haplotypes. Trop Med Int Health. 2006, 11: 1503-11.
34. Ashley EA, Pinoges L, TuryakiraE, Dorsey G, Checchi F, Bukirwa H, van den Broek I, Zongo I, Palma Urruta PP, van Herp M, Balkan S, Taylor WR, Olliaro P, Guthmann JP. Different methodological approaches to the assessment of in vivo efficacy of three artemisinin-based combination antimalarial treatments for the treatment of uncomplicated falciparum malaria in African children. Malaria Journal 2008, 7 ; 154.
35. Färnert A, Lebbad M, Faraja L, Rooth I. Extensive dynamics of Plasmodium falciparum densities, stages and genotyping profiles Malaria Journal 2008, 7:241 doi:10.1186/1475-2875-7-241.
36. Ridder (de) S, Kooy (van der) F, Verpoorte R. Artemisia annua as a self-reliant treatment for malaria in developing countries. J Ethnopharmacol 2008, 8 : 302-314.
37. Ogwang PE. Artemisia Annua L. Infusion Consumed Once a Week Reduces Risk of Multiple Episodes of Malaria: A Randomised Trial in a Ugandan Community. Tropical Journal Pharmaceutical Research, 2012, 13: 445-453.
38. Chiung-Sheue Chen Liu K, Yang SL, Roberts MF, Elford BC, Phillipson JD. Antimalarial activity of Artemisia annua flavonoids from whole plants and cell cultures. Plant Cell Reports, 1992, 11 ; 637-40.
39. van der Kooy F,Sullivan SE. The complexity of medicinal plants: The traditional Artemisia annua formulation, current status and future perspectives. Journal of Ethnopharmacology (2013), http://dx.doi.org/10.1016/j.jep.2013.08.021i
40. Woerdenbag HJ, Pras N, Bos R, Visser JF, Hendriks H, Malingré TM. Analysis of artemisinin and related sesquiterpenoids from artemisia annua L. by combined gas chromatography/mass spectrometry. Phytochemical Analysis, 1991, 2 : 215–219.
41. Akowuah GA, Zhari I. Effect of Extraction Temperature on Stability of Major Polyphenols and Antioxidant Activity of Orthosiphon stamineus Leaf. Journal of Herbs, Spices & Medicinal Plants, 2010 ; 160-66.
42. Akpotuzor JO, Udoh AE Etukudo MH. Total Antioxidant Status, Vitamins A, C and $-carotene Levels of Children with P. Falciparum Infection in University of Calabar Teaching Hospital (UCTH), Calabar. Pakistan J of Nutrition, 2007, 6 : 485-89.
43. Metzger A, Mukasa G, Shankar A H., Ndeezi G, Melikian G, Semba R D. Antioxidant status and acute malaria in children in Kampala, Uganda. Am J Trop Med Hyg 2001, 65 : 115-19.
44. Mouton J, Jansen O, Frédérich M, van der Kooy F. Is Artemisinin the Only Antiplasmodial Compound in the Artemisia annua Tea Infusion? An in Vitro Study. Planta Med. 2013 Apr;79(6):468-70. doi: 10.1055/s-0032-1328324. Epub 2013 Mar 19.
45. Ferreira JFS, Luthria DL, Sasaki T, Heyerick A. Flavonoids from Artemisia annua as antioxidants and their potential synergism with artemisinin against malaria and cancer. Molecules 2010, 15, 3135-3170.
46. Ashton M, Hai TN, Sy ND, Huong DX, Van Huong N, Niêu NT and Công LD. Artemisinin Pharmacokinetics is Time-Dependent during Repeated Oral Administration in Healthy Male Adults. Drug Metabolism and Distribution, 1998. 26 : 25-27.
47. Melillo de Magalhães, P., et al. Anti-inflammatory effect and modulation of cytochrome P450 activities by Artemisia annua tea infusions in human intestinal Caco-2 cells. Food Chemistry (2012), http://dx.doi.org/10.1016/j.foodchem.2012.02.195
48. Willcox M L, Burton S, Oyweka R, Namyalo R, Challand S, Lindsey K. Evaluation and pharmacovigilance of projects promoting cultivation and local use of Artemisia annua for malaria. Malaria Journal 2011, 10:84 doi:10.1186/1475-2875-10-84.
49. Xie G, Schepetkin IA, Siemsen DW, Kirpotina LN, Wiley JA, Quinn MT. Fractionation and Characterization of Biologically-active Polysaccharides from Artemisia tripartita. Phytochemistry. 2008, 69: 1359–1371.
50. Lehane AM and Saliba Kevin J. Common dietary flavonoids inhibit the growth of the intraerythrocytic malaria parasite. BMC Research Notes 2008, 1:26.
51. Su V, King D, Woodrow I, McFadden G, Gleadow R. Plasmodium Falciparum growth is arrested by monoterpenes from eucalyptus oil. Flavour Fragr J, 2008 ; 23 :315-18.
52. Ayoola GA , Coker HAB, Adesegun SA, Adepoju-Bello AA, Obaweya K, Ezennia EC, Atangbayila TO. Phytochemical Screening and Antioxidant Activities of Some Selected Medicinal Plants Used for Malaria Therapy in Southwestern Nigeria. Tropical Journal of Pharmaceutical Research, September 2008; 7: 1019-1024.
53. Goulart H R, Kimura E A, Peres V J, Couto A S, Aquino Duarte F A, Katzin A M. Terpenes Arrest Parasite Development and Inhibit Biosynthesis of Isoprenoids in Plasmodium falciparum Antimicrobial Agents and Chemotherapy, July 2004, 48 : 2502-9.
54. Ashley EA, Pinoges L, TuryakiraE, Dorsey G, Checchi F, Bukirwa H, van den Broek I, Zongo I, Palma Urruta PP, van Herp M, Balkan S, Taylor WR, Olliaro P, Guthmann JP. Different methodological approaches to the assessment of in vivo efficacy of three artemisinin-based combination antimalarial treatments for the treatment of uncomplicated falciparum malaria in African children. Malaria Journal 2008, 7 ; 154.
55. Walker D.J. Mechanisms of artemisinin resistance in the rodent malaria pathogen Plasmodium yoelii. Antimicrob. Agents Chemother. 2000 ; 44: 344–347.
56. Dondorp AM, Nosten F, Yi P, Das D, Phyo AP, Tarning J, Lwin KM, Ariey F, Hanpithakpong W, Lee SJ, Ringwald P, Silamut K, Imwong M, Chotivanich K, Lim P, Herdman T, An SS, Yeung S, Singhasivanon P, Day NP, Lindegardh N, Socheat D, White NJN. Artemisinin resistance in Plasmodium falciparum malaria. Engl J Med. 2009, 361 : 455-67.
57. Ashley EA et al. Spread of Artemisinin Resistance in Plasmodium falciparum Malaria. N Engl J Med 2014;371:411-23. DOI: 10.1056/NEJMoa1314981
58. Feng R, Isman MB. Selection for resistance to azadirachtin in the green peach aphid,Myzus persicae. Experientia,1995, 51, 831-833.
59. Gueye PO, Diallo M, Deme AB, Badiane AS, Dior DM, Ahouidi A, Abdoul Aziz N, Dieng T, Lutgen P, Mboup S, Sarr O. Tea Artemisia annua inhibits Plasmodium falciparum isolates collected in Pikine, Senegal. Afr. J. Biochem. Res. 2013, 7, 107-13, DOI: 10.5897/AJBR12.022
60. De Donno A, et al. First-time comparison of the in vitro antimalarial activity of Artemisia annua herbal tea and artemisinin. Trans R Soc Trop Med Hyg (2012), http://dx.doi.org/10.1016/j.trstmh.2012.07.008
61. Wan YD, Zang QZ, Wang JS. Studies on the antimalarial action of gelatin capsule of Artemisia annua. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. 1992;10(4):290-4.
62. Elfawal MA, Towler MJ, Reich NG, Golenbock D, WeathersPJ, Rich SM. Dried Whole Plant Artemisia annua as an Antimalarial Therapy Plosone.org 1 December 2012 | Volume 7 | Issue 12 | e52746.
63. Whole-leaf artemisia annua-based antimalarial drug: report on proof-of-concept studies. A collaborative project between ICIPE, KEMRI and N.U.S.AG. International Centre of Insect Physiology and Ecology (ICIPE), P. O. Box 30772, 00100, Nairobi, Kenya, 2005.
64. Weathers P J, Towler M J. Changes in key constituents of clonally propagated Artemisia annua L. during preparation of compressed leaf tablets for possible therapeutic use. Industrial Crops and Products 2014; 62:173–178. DOI: 10.1016/j.indcrop.2014.08.033
LA TOXICITE DE L’ARTEMISINE
La tolérance à l’artémisine est très bonne. On ne retrouve dans la littérature aucune publication rapportant des complications après traitement par artémisine ou dérivés ; il n’a pas été observé d’effets secondaires indésirables (1). Les seuls effets remarquables sont des nausées, parfois des vomissements ; quelques cas de diarrhée ont été signalés. Cependant ces symptomes sont également présents au cours de l’accès palustre, et il est donc difficile de les attribuer à la maladie ou au traitement.
De très nombreuses recherches sur la toxicité ont été réalisées, en particulier chez l’animal (2).
Cependant l’essentiel de ces recherches porte sur les dérivés de l’artémisine plus que sur l’artémisine elle-même (3). Il existe une neurotoxicité qui a été observée surtout avec des dérivés non hydrosolubles (artemether) et non pas avec l’artémisine elle-même, qui est hydrosoluble. Cette neurotoxicité a été observée chez l’animal avec des doses très élevées, allant jusqu’à 600 mg/kg/jour, alors que les doses recommandées par l’OMS chez l’homme sont comprises entre 2 et 8 mg/kg/jour, donc 100 fois plus faibles.
L’administration prolongée d’artesunate provoque des troubles du rythme cardiaque. Les dérivés de l’artémisine sont également inhibiteurs de l’érythropoièse, c’est-à-dire de la fabrication des globules rouges ; une baisse du nombre de réticulocytes (précurseurs des globules rouges) a été retrouvée chez l’animal et chez l’homme après administration d’artésunate et d’artemether, mais cette baisse reste toujours modérée et régressive à l’arrêt du traitement.
L’embryotoxicité reste un sujet débattu ; elle a été observée chez l’animal, mais n’a pas été retrouvée chez l’homme. McGready (4) a colligé 539 accès palustres traités chez 461 femmes enceintes : aucune différence avec la population générale n’a été retrouvée, que ce soit en termes d’avortements, d’enfants morts-nés, de malformations congénitales ou de durée de gestation.
De même aucun effet néfaste n’a été retrouvé dans la méta-analyse de Dellicour (5), qui porte sur 14 études, soit 945 femmes enceintes.
Un mécanisme d’embryotoxicité possible est l’inhibition de l’érythropoièse ; durant les premiers mois de la gestation, ceci pourrait être cause d’avortements spontanés à un stade précoce où la grossesse est encore méconnue ; en tout état de cause, en se basant sur les constatations faites sur l’animal, on peut déconseiller l’usage d’artémisine durant les trois premiers de la gestation, même si le risque semble essentiellement théorique. Une cytotoxicité et une génotoxicité ont été constatées chez l’animal, mais après un traitement au long cours, ce qui n’est jamais le cas chez l’homme, où la durée du traitement ne dépasse pas 7 jours.
Au total, on peut dire que l’artémisine ou plutôt ses dérivés peuvent être toxiques quand les concentrations sont maintenues élevées pendant longtemps (2,3); par ailleurs le mode d’administration joue un rôle : la voie orale, caractérisée par une absorption et une élimination rapides est relativement sans risques, comparée à la voie parentérale (diffusion beaucoup plus progressive dans l’organisme). Enfin on n’a jamais constaté de toxicité de l’artémisine elle-même aux doses utilisées dans le traitement de l’accès palustre.
Références
1. Taylor WR1, White NJ. Antimalarial drug toxicity: a review. Drug Saf. 2004;27(1):25-61.
2. Efferth T, Kaina B. Toxicity of the antimalarial artemisinin and its dervatives. Crit Rev Toxicol. 2010 May;40 : 405-21. doi: 10.3109/10408441003610571.
3. Yin JY, Wang HM, Wang QJ, Dong YS, Han G, Guan YB, Zhao KY, Qu WS, Yuan Y, Gao XX, Jing SF, Ding RG. Subchronic toxicological study of two artemisinin derivatives in dogs. PLoS One. 2014 ;9:e94034. doi: 10.1371/journal.pone.0094034. eCollection 2014.
4. McGready R, Cho T, Villegas S, Brockmann A, van Vugt M, Looareesuwan S, White NJ, Nosten F Randomized comparison of quinine-clindamycin versus artesunate in the treatment of Plasmodium Falciparum malaria in pregnancy Trans R Soc Trop Med Hyg 2001, 95: 651-666.
5. Dellicour S, Hall S2, Chandramohan D, Greenwood B. The safety of artemisinins during pregnancy: a pressing question. Malaria Journal 2007, 6:15 doi:10.1186/1475-2875-6-15.
L’ADMINISTRATION DE L’ARTEMISINE
1. La tisane
1.1. La préparation de la tisane
La quantité de feuilles recommandée pour la préparation en tisane est de 5 à 7 grammes de feuilles pour un litre d’eau bouillante (2 à 3 grosses pincées). Il faut utiliser un récipient en plastique ou mieux en verre pour faire infuser, et éviter un récipient en fer (le fer réagissant avec l’artémisine). Il faut verser l’eau bouillante sur les feuilles (ne pas poursuivre l’ébullition avec les feuilles, car cela détruit l’artémisine), remuer le mélange avec une cuiller en bois, puis laisser infuser 10 minutes, le récipient étant recouvert. Puis il faut filtrer la tisane (par exemple dans un tissu pour éviter le contact avec une passoire en fer), presser les feuilles pour récupérer les reliquats d’artémisine dissoute, et enfin laisser refroidir la tisane.
1.2. La posologie de la tisane
Chez l’adulte, la posologie recommandée est de 1 litre par jour en 4 prises de 250 ml.
Chez l’enfant, la posologie est de 15 à 20 cc/kg, c’est-à-dire ½ litre en 4 prises pour un poids de 30 kg (4 fois un pot de yaourt bien rempli), ou 120 à 130 ml en 4 prises pour un poids de 7 kg (4 fois un quart de pot de yaourt).
La voie orale est bien sur le moyen le plus simple pour administrer la tisane.
Pour diminuer l’amertume de la tisane, on peut l’adoucir avec adjonction de sucre ou miel, ou mieux encore de stevia. Cependant, lorsque la voie orale est impossible, comme chez des patients peu coopérants ou en cas de neuropaludisme avec coma, l’administration par voie rectale est possible.
Cette possibilité a été soulignée et encouragée par l’OMS (1). L’artémisine par voie rectale a l’avantage d’éviter les complications que l’on peut observer si l’on traite l’accès palustre par injection de quinine intramusculaire (2).
Plusieurs études ont confirmé l’efficacité de l’artémisine par voie rectale (3,4,5,6,7,8) : celle-ci élimine le parasite plus rapidement que les traitements classiques intramusculaires ou intraveineux par sels de quinine, et elle est plus efficace et plus sûre que la quinine parentérale, même en cas de paludisme sévère.
Selon Koopmans (7) la concentration sanguine en artémisine administrée par voie rectale est plus élevée qu’après administration de la même dose par voie orale, avec un temps d’élimination du parasite d’environ 24 heures, donc plus rapide que par voie orale.
Dans l’étude de Gomes qui porte sur 1167 patients (5), une dose massive unique était 5 fois plus efficace que des doses modérées répétées pour réduire la parasitémie de plus de 90% à 24 heures.
A partir d’une méta-analyse de 39 publications, Karunajeewa (6) conclut à l’efficacité thérapeutique de l’artémisine par voie rectale, même si les résultats cliniques ne sont pas supérieurs à ceux des traitements conventionnels.
Ainsi l’artémisine par voie rectale peut être considérée comme un traitement alternatif pouvant remplacer la quinine parentérale.
Différentes présentations de suppositoires sont actuellement disponibles, à base d’artémisine extraite de l’Artemisia annua, ou à base de ses dérivés semi-synthétiques ; cependant le coût peut en être prohibitif pour les familles les plus pauvres, et on peut remplacer les suppositoires par de la tisane d’Artemisia annua, administrée selon le même protocole que par voie orale, c’est-à-dire pour l’adulte un litre de tisane dans laquelle ont infusé 9 à 10 grammes de feuilles d’Artemisia annua, à répéter les jours suivants. La tisane est disponible à un coût minime ou quasi-nul ; elle peut être administrée par voie rectale sous forme de goutte-à-goutte à l’aide d’une canule rectale. Ceci a l’avantage de réhydrater l’enfant.
2. La poudre d’Artemisia annua
L’administration de la poudre permet d’administrer la plante elle-même, et ainsi d’absorber le « totum », c’est-à-dire la totalité des molécules présentes, à la différence de la tisane.
2.1. Préparation de la poudre :
Il faut réduire la plante en poudre fine ; ceci peut facilement être fait avec un mixer, mais est plus difficile à obtenir en zone endémique avec le pilon traditionnel. Il est important que la plante soit parfaitement pulvérisée.
2.2. Administration de la poudre :
2.2.1. La poudre peut ensuite être administrée sous forme de gélules ou de comprimés, qui sont d’absorption facile. Les gélules sont également utilisables par voie rectale en cas de neuropaludisme avec difficultés d’alimentation. Weathers (9) a constaté que la concentration en artémisine et en flavonoïdes n’était pas modifiée ou même augmentait par la pulvérisation des feuilles d’Artemisia annua et la compression en comprimés.
Dien (10) a constaté que l’absorption d’artémisine en gélules n’était pas modifiée par la prise simultanée de nourriture. Mais les gélules et les comprimés ne sont pas toujours facilement disponibles et par ailleurs ils ont un coût. Ce mode d’administration est donc possible lorsque les gélules ou les comprimés sont préparés à l’avance et apportées dans la zone de distribution, mais il est imparfaitement adapté pour un programme de production locale ou de diffusion à grande échelle.
2.2.2. Une alternative est d’utiliser la poudre d’Artemisia annua non pas en gélules, mais de l’administrer directement, diluée dans de la bouillie ou encore dans du beurre d’arachide, à condition qu’elle soit parfaitement pulvérisée. La dose est d’une petite cuiller à café remplie à ras 4 fois par jour. Comme nous l’avons vu, l’efficacité du traitement par la poudre semble supérieure à celle de la tisane, et ce mode d’administration nous semble à promouvoir chaque fois que cela est possible.
Références
1. Use of rectal artemisinin-based suppositories in the management of severe malaria. Report of a WHO Informal Consultation, 27–28 March 2006, World Health Organization, Geneva 2007.
2. Onimus M, Brunet L, Gaudeuille A, Issa Mapouka A. Le traitement des séquelles d’injections intramusculaires de sels de quinine en milieu africain. Med Trop 2007 ; 67: 63-75.
3. Ashton M, Nguyen DS, Nguyen VH, Gordi T, Trinh NH, Dinh XH, Nguyen TN, Le DC. Artemisinin kinetics and dynamics during oral and rectal treatment of uncomplicated malaria. Clin Pharmacol Ther 1998; 63: 482-13.
4. Birku Y, Makonnen E, Björkman A. Comparison of rectal artemisinin with intravenous quinine in the treatment of severe malaria in Ethiopia. East Afr Med J 1999; 76:154-9.
5. Gomes M, Ribeiro I, Warsame M, KarunajeewaH, Petzold M. Rectal artemisinin for malaria: a review of efficacy and safety from individual patient data in clinical studies. BMC Infect Dis 2008, 28: 38-9.
6. Karunajeewa HA, Manning L, Mueller I, Ilett KF, Davis TM. Rectal administration of artemisin derivatives for the treatment of malaria. JAMA 2007, 297: 2381-90.
7. Koopmans R, Ha LD, Duc DD, Dien TK, Kager PA, Khanh NX, Boxtel (van) CJ, Vries (de) PJ. The pharmakinetics of artemisinin after administration of two different suppositories to healthy Vietnamese subjects. Am J Trop Med Hyg 1999, 60:244-7.
8. Mehta SR, Das S. Management of malaria: recent trends. J Commun Dis 2006, 38:130-8.
9. Weathers PJ, Towler MJ. Changes in key constituents of clonally propagated Artemisia annuaL. during preparation of compressed leaf tablets for possibletherapeutic use. Industrial Crops and Products 62 (2014) 173–178.
10. Dien TK, de Vries PJ, Khanh NX, Koopmans R, Binh LN, Duc DD, Kager PA, van Boxtel CJ. Effect of food intake on pharmacokinetics of oral artemisinin in healthy Vietnamese subjects. Antimicrob Agents Chemother. 1997 May;41(5):1069-72.
CONCLUSION
On sait qu’actuellement la production d’artémisine est insuffisante pour répondre à la demande mondiale et que par ailleurs le coût en est prohibitif pour la plupart des zones endémiques.
Il existe des programmes de distribution gratuite des traitements modernes, à base d'artémisine associée à des molécules à action lente (ACT), mais ces programmes contribuent a maintenir les populations ciblées en état d'assistanat…
On sait également que les traitements par Artémisia Annua sont efficaces à près de 100%, que ce soit en tisane ou en poudre, et qu’ils réalisent une polythérapie très supérieure au traitement par la seule molécule d’artémisine.
L’Artémisia annua présente l’avantage d’être très peu onéreuse et économiquement acceptable pour le traitement du paludisme, même pour les populations les plus défavorisées ; la tisane et la poudre sont faciles à préparer et à administrer.
Un avantage supplémentaire est la possibilité d’une culture locale, favorisant l'autonomisation de la population, et éliminant les incertitudes de l’acheminement et de la distribution, de même que les risques de rupture de stock.
Que ce soit par voie orale ou par voie rectale, sous forme de tisane ou de poudre, l’Artémisia annua permet de traiter efficacement l’accès palustre dû au plasmodium falciparum, à condition toutefois que la durée du traitement soit suffisante.
Ceci doit rester présent à l’esprit d’autant que cette indispensable durée du traitement est parfois difficile à obtenir des patients ou de leur famille. Malgré cet inconvénient, le traitement de l’accès palustre par l’Artémisia annua parait donc une alternative recommandable.
Projet de production locale et de traitement dans les pays les plus pauvres
artemisine français janvier 2015.pdf
Document Adobe Acrobat [1.8 MB]
expérience gélules artémisia anglais pub[...]
Document Adobe Acrobat [2.4 MB]